
乙醇与重铬酸根离子在酸性溶液中能发生如下反应:C2H5OH+Cr2O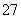 +H+―→CO2↑+Cr3++H2O,当这个方程式配平后,H+的化学计量数为( )
+H+―→CO2↑+Cr3++H2O,当这个方程式配平后,H+的化学计量数为( )
A.10 B.12
C.14 D.16
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.含1 mol溶质的任何溶液,物质的量浓度一定相等
B.配制1 mol·L-1NaCl溶液1 L,其方法是:将58.5 g NaCl溶于1 L水中
C.体积相同、物质的量浓度相同的同种溶液所含溶质的粒子数一定相同
D.1 L 0.5 mol·L-1 CaCl2溶液中,Ca2+与Cl-的物质的量浓度都是0.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
铁丝在氯气中燃烧时,可观察到的现象是____________________,反应的化学方程式为__________________________,然后向燃烧后的集气瓶中加入少量水,振荡,可观察到溶液呈________色。
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式为( )
A.碳酸氢钠溶液中滴入氢氧化钙溶液:HCO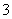 +OH-=== CO
+OH-=== CO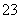 +2H2O
+2H2O
B.二氧化硫通入次氯酸钠溶液:SO2+ClO-+2OH-===SO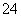 +Cl-+H2O
+Cl-+H2O
C.硫化钡加入稀硫酸:BaS+2H+===H2S↑+Ba2+
D.新制的氧化铝可溶于氢氧化钠溶液:Al2O3+2OH-===2AlO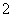 +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物A、B是中学常见的物质,其阴阳离子可从下表中选择
| 阳离子 | K+ 、Na+ 、Fe2+ 、Ba2+、NH |
| 阴离子 | OH-、NO |
(1)若A、B的水溶液均为无色,B的水溶液呈碱性,且混合后只产生不溶于稀硝酸的白色沉淀及能使红色石蕊试纸变蓝的气体。
①B的化学式为_________________________________________________________。
②A、B溶液混合后加热呈中性,反应的离子方程式为
________________________________________________________________________。
(2)若A的水溶液呈浅绿色,B的水溶液无色且其焰色反应为黄色。向A的水溶液中加入稀盐酸无明显现象,再加入B后溶液变黄,但A、B的水溶液混合亦无明显变化。则
①A为___________________________________________________________。
②经分析上述过程中溶液变黄的原因可能有两种:
Ⅰ.________________________________________________________________________。
Ⅱ.________________________________________________________________________。
③请用一简易方法证明上述溶液变黄的原因__________________________________。
④利用溶液变黄原理,将其设计成原电池,若电子由a流向b,则b极的电极反应式为
______________________________________________________________________ __
__
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
Cl2是纺织工业中常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”,S2O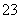 与Cl2反应的产物之一为SO
与Cl2反应的产物之一为SO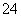 。下列说法中,错误的是( )
。下列说法中,错误的是( )
A.该反应中的氧化剂是S2O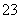
B.SO2与氯气的漂白原理相同,所以也可以用SO2作纺织工业的漂白剂
C.上述反应中,每生成1 mol SO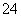 ,
, 可脱去2 mol Cl2
可脱去2 mol Cl2
D.根据该反应可判断还原性:S2O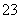 >Cl-
>Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的主族元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)元素D在周期表中的位置__________。
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)______。
(3)由A、B、C三种元素以原子个数比4∶2∶3形成化合物X,X中所含化学键类型有________________________________________________________________________。
(4)若E是金属元素,其单质与氧化铁反应常用于焊 接钢轨,请写出反应的化学方程式:________________________________________________________________________。
接钢轨,请写出反应的化学方程式:________________________________________________________________________。
若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:_______________ ___________________________________________________
___________________________________________________
_________________________________ _______________________________________。
_______________________________________。
(5)FC2气体有毒,排放到大气中易形成酸雨,写出FC2与氧气和水蒸气反应的化学方程式_____________________________________________________________________________
_______________ _________________________________________________________。
_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁是中学常见的物质,其中甲、乙、丙均含有同一种元素,在一定条件下的转化关系如图,下列说法正确的是( )

A.若丁为用量最大,用途最广的金属单质,乙的溶液一定为FeCl3
B.若通常情况下甲、乙、丙、丁都是气体,且乙和丁为空气的主要成分,
则反应①的化学方程式4NH3+5O2 4NO+6H2O
4NO+6H2O
C.若甲、乙、丙的溶液显碱性,丙可作为医疗上治疗胃酸过多症的药剂,将等物质的
量的乙和丙溶于水形成混合溶液,溶液中各离子浓度由大到小的顺序为
c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)> c(H+)
D.若丁为化合物,且为氯碱工业的重要产品,则甲一定为含Al3+的盐
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com