
下列实验能达到预期目的的是
编号 | 实验内容 | 实验目的 |
A | 室温下,用pH试纸分别测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
B | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
C | 常温下,测得饱和Na2CO3溶液的pH大于饱和NaHCO3溶液 | 常温下水解程度:CO32- > HCO3 - |
D | 取两只试管,分别加入4 mL 0.01 mol/L KMnO4酸性 溶液,然后向一只试管中加入0.1 mol/L H2C2O4溶液 2 mL,向另一只试管中加入0.1 mol/L H2C2O4溶液 4 mL,记录褪色时间 | 证明草酸浓度越大,反应 速率越快 |
B
【解析】
试题分析:NaOH是强碱,HClO、CH3COOH是弱酸,因此它们产生的盐都是强碱弱酸盐,水解使溶液显碱性。但是NaClO溶液水解产生的HClO有漂白性,因此不能通过用PH试纸测定溶液的pH比较HClO和CH3COOH的酸性强弱,A错误; Na2CO3是强碱弱酸盐,水解消耗水电离产生的H+而使溶液显碱性,因此向该盐的水溶液中滴加酚酞变为红色。若向含有酚酞的Na2CO3溶液中加入少量BaC12固体,会发生反应:CO32-+Ba2+=BaCO3↓,使CO32-的水解平衡逆向移动。水解程度减小,所以溶液的减小减弱,溶液红色变浅。B正确;饱和Na2CO3溶液的浓度和饱和NaHCO3溶液的浓度不相等,不具有可比性,C错误;两只试管中草酸的浓度几乎是相同的,所以不能证明H2C2O4浓度越大反应速率越快,D不正确;
考点:考查实验操作与实验目的的关系的知识


科目:高中化学 来源:2014-2015浙江省高二1月月考化学试卷(解析版) 题型:选择题
为了得到比较纯净的物质,使用的方法恰当的是
A.向Na2CO3饱和溶液中,通过量CO2后,在减压、加热的条件下,蒸发得NaHCO3晶体
B.加热蒸发AlCl3饱和溶液得纯净的AlCl3晶体
C.向FeBr2溶液中加入过量的氯水,加热蒸发得FeCl3晶体
D.向FeCl3溶液里加入足量NaOH溶液,经过滤、洗涤沉淀,再充分灼烧沉淀得Fe2O3
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省平度市高二上学期期中考试化学试卷(解析版) 题型:填空题
(14分)电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:

(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为 。
在X极附近观察到的实验现象是 。
②Y电极上的电极反应式为 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是 ,电极反应式为 。
②Y电极的材料是 ,电极反应式为 。(说明:杂质发生的电极反应不必写出)
电解一段时间后,CuSO4溶液的浓度将 (填“变大”、“变小”或“不变”)
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省平度市高二上学期期中考试化学试卷(解析版) 题型:选择题
对于反应C(s)+H2O(g)  CO(g)+H2(g) ;ΔH >0,下列有关说法正确的是
CO(g)+H2(g) ;ΔH >0,下列有关说法正确的是
A.平衡常数表达式为K=
B.增大体系压强,平衡常数K不发生变化
C.升高体系温度,平衡常数K减小
D.增加C(s)的量,平衡正向移动
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省高二上学期期中考试化学试卷(解析版) 题型:选择题
在一个密闭绝热容器(W)中,进行如下两个可逆反应:
①A(g)+2B(g)  3C(g)+D(s) ΔH1>0,②xM(g)+N(g)
3C(g)+D(s) ΔH1>0,②xM(g)+N(g) 3Q(g) ΔH2。
3Q(g) ΔH2。
反应①中各物质与反应②中各物质均不发生反应。在某容器里只进行反应②,M的转化率与温度、压强的关系如图所示。

下列对W容器中进行的反应推断合理的是
A.反应①一定是自发反应,反应②一定是非自发反应
B.若容器内温度保持不变,则v正(B):v逆(C)=2:3
C.若恒压条件下,充入N,则C的物质的量减小
D.升高温度,两个反应的平衡常数都减小
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省高二上学期期中考试化学试卷(解析版) 题型:选择题
常温下,将0.1 mo1·L一1的醋酸溶液加水稀释至原来体积的10倍,下列有关叙述正确的是
A.CH3 COOH的电离平衡常数增大为原来的10倍
B.CH3 COO一与CH3 COOH的浓度之比增大为原来的10倍
C.CH3 COO一与H十的浓度之积减小为原来的0.1倍
D.CH3 COOH与CH3 COO—的浓度之和减小为原来的0.1倍
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省赣州市北校区高二1月月考化学试卷(解析版) 题型:填空题
(10分)某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中的溶质足量),当闭合该装置的电键K时,观察到电流表的指针发生了偏转。

请回答下列问题:
(1)甲池为_____(填“原电池”、“电解池”或“电镀池”),A电极的电极反应式为 。
(2)丙池中F电极为________(填“正极”、“负极”、“阴极”或“阳极”),该池的总反应方程式为______。
(3)当乙池中C极质量减轻10.8 g时,甲池中B电极理论上消耗O2的体积为________mL(标准状况)。
(4)一段时间后,断开电键K。下列物质能使乙池恢复到反应前浓度的是________(填字母)。
A.Cu B.CuO C.Cu(OH)2 D.Cu2(OH)2CO3
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省赣州市北校区高二1月月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.热化学方程式中的化学计量数可表示物质的量,因此可用分数表示
B.热化学方程式中表明的热量是指每摩尔反应物反应时吸收或放出的热量
C.1 mol碳燃烧所放出的热量为燃烧热
D.1 mol强酸和1 mol强碱完全反应所放出的热量称为中和热
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省高二12月月考化学(选修)试卷(解析版) 题型:选择题
下列各组物质中,一定属于同系物的是
A.HCHO、CH3COOH
B.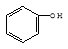 、
、 、
、
C.C2H4、C6H12
D.乙酸、硬脂酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com