
【题目】(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气和水,放出热量624kJ(25℃时),则N2H4完全燃烧反应的热化学方程式是___________________________________________________。
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是30%的KOH溶液。肼—空气燃料电池放电时:正极的电极反应式是______________________________。负极的电极反应式是_____________________________。
(3)下图是一个电化学过程示意图。
①锌片上发生的电极反应是___________________。
②假设使用肼—空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池理论上消耗标标准状况下的空气__________L(假设空气中氧气体积含量为20%)

【答案】N2H4(1)+O2(g)=N2(g)+2H2O(1);△H=-624kJ/mol O2+2H2O+4e-=4OH- N2H4+4OH--4e-=4H2O+N2↑ Cu2++2e-=Cu 112
【解析】
(1)根据肼和反应热的关系计算出其燃烧热,并写出其相应的热化学方程式;
(2)燃料电池中,负极上投放的是燃料,负极上燃料失电子发生氧化反应;
(3)①电解池的负极上是阳离子发生得电子的还原反应;②根据电极反应,结合电子守恒和空气的组成情况来回答。
(1))32.0g肼的物质的量为1mol,1molN2H4在氧气中完全燃烧生成氮气放出热量624kJ,所以其热化学反应方程式为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol,故答案为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol;
(2)燃料电池中,负极上投放的是燃料,负极上燃料失电子发生氧化反应,在碱性环境下的反应式为:N2H4+4OH--4e-=4H2O+N2↑,正极上是氧气发生得电子的还原反应,在碱性环境下,电极反应式为:2H2O+O2+4e-=4OH-,故答案为:2H2O+O2+4e-=4OH-;N2H4+4OH--4e-
=4H2O+N2↑;
(3)①电解池的负极上是阳离子铜离子发生得电子的还原反应,即Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu;
②铜片上的电极反应为:Cu-2e-=Cu,Cu的质量变化128g,根据电极反应,转移电子为4mol,根据反应N2H4+O2=N2+2H2O,当转移电子4mol时,消耗氧气的物质的量是1mol,氧气的体积是空气体积的五分之一,所以消耗空气的体积是5mol,即112L,故答案为:112。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】下列表述错误的是( )
A. CS2的结构式为:S=C=S
B. 6CO2+6H2O![]() C6H12O6+6O2,该变化中光能转变为化学能
C6H12O6+6O2,该变化中光能转变为化学能
C. CO2(g)+C(s)![]() 2CO(g)△H>0,△S>0,该反应常温下能自发进行
2CO(g)△H>0,△S>0,该反应常温下能自发进行
D. 可以用酸性高锰酸钾溶液来鉴别乙醇、乙酸和苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有pH=3的HCl溶液100 mL,要使它的pH=4,如果加入蒸馏水,需加水_____ mL (假定溶液体积有加和性,下同)。
(2)常温下,将pH=8的NaOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH=_______。
(3)今有A.盐酸 B.醋酸 C.硫酸三种酸:
①在同体积、同浓度的三种酸中,分别加入足量的碳酸氢钠粉末,在相同条件下产生CO2的体积由大到小的顺序是______________.(填写酸的序号并用符号“>、<、=”连接,下同)
②在同体积、同pH的三种酸中,同时加入形状、密度、质量完全相同的锌粒,若产生相同体积的氢气(同温同压下),则开始反应时速率大小关系是__________,反应所用时间长短关系是_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明氯化氢是共价化合物的现象是
A.氯化氢极易溶于水 B.液态氯化氢不能导电
C.氯化氢在水溶液中完全电离 D.氯化氢是无色有刺激性气味的气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pKa=-lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。用0.1 mol·L-1NaOH溶液滴定20mL 0.1mol·L-1H2SO3溶液的滴定曲线如下图所示(曲线上的数字为pH)。下列说法正确的是
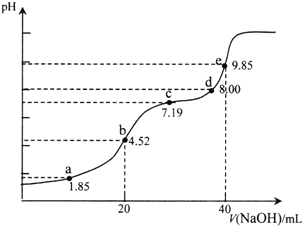
A. a点所得溶液中:2c(HSO3-)+c(SO32-)=0.1mol/L
B. b点所得溶液中:c(H+)+c(SO32-)=c(OH-)+c(H2SO3)
C. c点所得溶液中:c(Na+)>3c(HSO3-)
D. e点所得溶液中:c(Na+)> c(SO32-)> c(H+)> c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“来自石油和煤的两种基本化工原料”A和甲。A是气态烃,甲是液态烃。B和D是生活中两种常见的有机物。以A为主要原料合成乙酸乙酯。其合成路线如图所示。已知醛在一定条件下能被氧化为羧酸

(1)A分子的电子式是________;C的分子式是________。
(2)在反应①~④中,属于加成反应的是________(填序号)。
(3)B和D反应进行比较缓慢,提高该反应速率的方法主要有______________。
(4)写出反应②的化学方程式____________________________。
(5)可用于鉴别B、D和甲的一种试剂是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑(Sb)广泛用于生产各种阻燃剂、陶瓷、半导体元件、医药及化工等领域。以辉锑矿为原料制备金属锑,其一种工艺流程如下:

己知部分信息如下:
I.辉锑矿(主要成分为Sb2S3,还含有As2S5、PbS 、CuO和SiO2等);
II.浸出液主要含盐酸和SbCl3,还含SbCl5、CuCl2、AsCl3和PbCl2等杂质;
III.常温下,Ksp(CuS)=1.0×10-36 Ksp(PbS)=9.0×10-29
回答下列问题:
(1)“酸浸”过程中SbCl5和Sb2S3反应有S生成,该反应的还原产物是________(填化学式)。
(2)写出“还原”反应的化学方程式:______________ 。
(3)已知:浸出液中:c(Cu2+)=0.01 mol·L-1、c(Pb2+)=0.10 mol·L-1。在沉淀铜、铅过程中,缓慢滴加极稀的硫化钠溶液,先产生的沉淀是_______(填化学式);当CuS、PbS共沉时,![]() =_________。加入硫化钠的量不宜过多,原因是_________。
=_________。加入硫化钠的量不宜过多,原因是_________。
(4)在“除砷”过程中,氧化产物为H3PO4。该反应中氧化剂、还原剂的物质的量之比___________。
(5)在“电解”过程中,以惰性材料为电极,阴极的电极反应式为______;“电解”中锑的产率与电压大小关系如图所示。当电压超过U0V时,锑的产率降低的原因可能是______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
SO2(g)+2CO(g)![]() 2CO2(g)+S(l)△H<0 若反应在恒容的密闭容器中进行,下列有关说法正确的是
2CO2(g)+S(l)△H<0 若反应在恒容的密闭容器中进行,下列有关说法正确的是
A. 平衡前,随着反应的进行,容器内压强始终不变
B. 平衡时,其他条件不变,分离出硫,正反应速率加快
C. 平衡时,其他条件不变,升高温度可提高SO2的转化率
D. 其他条件不变,使用不同催化剂,该反应平衡常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向某浓度的ZnCl2溶液中滴加NaOH稀溶液直到Zn2+完全沉淀(浓度低于10-5mol/L),溶液pH分别为6、7、8时Zn2+浓度如图所示,其中A点恰好开始产生沉淀,下列说法错误的是

A. C点时Zn2+尚未沉淀完全
B. B点时c(C1-)-c(Na+)=0.0012mol/L
C. 原ZnCl2溶液的物质的量浓度大于0.12mol/L
D. 常温下Zn(OH)2的溶度积为1.2×10-17
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com