
����Ŀ�����������Դ�����ԭ�������ʣ��������ŷŷ�����ȶ�������ɫ��ѧ��![]() ����Ҫ������������Ҫ�Ǵ�����ɫ��ѧ���Ƕȿ��ǵ���(����)
����Ҫ������������Ҫ�Ǵ�����ɫ��ѧ���Ƕȿ��ǵ���(����)
��ʵ���Ҷ�ʱ�䱣������������Һʱ�����Լ�ƿ�������������ۣ�����ϡ�������Ũ�����ܽ⡢����������ʵ����Թ��ڱڵ���������ӡˢ��·�ķ�Һ�ܽ����м���Ȼ�����������ͭ������ҵ�ϳɰ��з������õ������͵�����ѭ��ʹ�á�
A.�٢ۢ�B.�ڢۢ�C.�٢ڢ�D.�٢ڢ�
���𰸡�B
��������
��ɫ��ѧ�ĺ��������û�ѧԭ����Դͷ�ϼ��ٺ�������ҵ�����Ի�������Ⱦ����ԭ�ӵ�������Ϊ100%��
��ʵ���Ҷ�ʱ�䱣������������Һʱ�����Լ�ƿ�������������ۣ���Ϊ�˷�ֹFe2+������ΪFe3+������ɫ��ѧ�أ�
����ϡ�������Ũ�����ܽ⡢����������ʵ����Թ��ڱڵ���������ϡ���ᷴӦ��������������ʹ������ѭ��ʹ�ã��������˷ѣ������˵���������ŷţ�������ɫ��ѧ��Ҫ��
��ӡˢ��·�ķ�Һ�к���FeCl2��CuCl2��FeCl3������Һ�м�����������ۣ����ˣ����õ��Ĺ���ϴ�Ӹ��T�ɵõ�ͭ�����Լ��ٷ�����ŷţ�������ɫ��ѧ��Ҫ��
�ܹ�ҵ�ϳɰ��з������õ������͵�����ѭ��ʹ�ã���Դͷ����������Ⱦ�������˷�����ŷţ�������ɫ��ѧ��Ҫ��
������ɫ��ѧҪ����Ǣڢۢܣ�
��ѡB��


 100�ִ�����ĩ���ϵ�д�
100�ִ�����ĩ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Dz�ͬ�¶���ˮ�����ӻ����ݣ�
�¶� | 25 |
|
|
ˮ�����ӻ����� |
|
|
|
�Իش��������⣺
![]() ��
��![]() ����
����![]() __________
__________![]() ����
����![]() ������
������![]() ������
������![]() ��
��![]() ���������жϵ�������__________��
���������жϵ�������__________��
![]() �£�ij
�£�ij![]() ��Һ��
��Һ��![]() ��ȡ����Һ
��ȡ����Һ![]() ����ˮϡ����
����ˮϡ����![]() ����ϡ�ͺ���Һ��
����ϡ�ͺ���Һ��![]() span>__________��
span>__________��
![]() �£���
�£���![]() �Ŀ�������Һ
�Ŀ�������Һ![]() ��
��![]() ��ϡ����
��ϡ����![]() ���
���![]() ���Ϻ���Һ�����Ϊԭ����Һ���֮��
���Ϻ���Һ�����Ϊԭ����Һ���֮��![]() �����û����Һ��
�����û����Һ��![]() ����
����![]() __________������Һ�и������ӵ�Ũ���ɴ�С������˳����__________________��
__________������Һ�и������ӵ�Ũ���ɴ�С������˳����__________________��
![]() �ֱ�����������ͬpH��HCl��Һ��
�ֱ�����������ͬpH��HCl��Һ��![]() ��Һ�м���������Zn�ۣ���Ӧ�տ�ʼʱ����
��Һ�м���������Zn�ۣ���Ӧ�տ�ʼʱ����![]() �����ʣ�
�����ʣ�![]() ______
______![]() ����
����![]() ������
������![]() ������
������![]() ����ͬ
����ͬ![]() ����Ӧ��ȫ������������������
����Ӧ��ȫ������������������![]() ����_______
����_______![]() ���ᡣ
���ᡣ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��HCl��NH4Cl��CH3COOH��CH3COONa����ѧ���������ʡ�
�ٳ�������pH=7��CH3COOH��CH3COONa�Ļ��Һ��c(Na+)_______c(CH3COO��)�����������������������
�ڳ�����pH��Ϊ6��HCl��NH4Cl������Һ�У�����ˮ���������H+Ũ�ȷֱ�Ϊamol/L��bmol/L����a��b�Ĺ�ϵ��_______��
A��a=b B��a��100b C��b��100a
��2��T�棬��һ�����Ϊ2L�������У�A������B���巴Ӧ����C���壬��Ӧ������A��B��C���ʵ����仯��ͼ��ʾ��
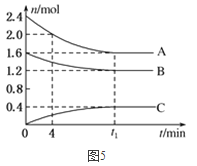
��T��ʱ���÷�Ӧ�Ļ�ѧ����ʽΪ________��
��0��4����ʱ��A��ƽ����Ӧ����Ϊ_______molL��1min��1��
�۴ﵽƽ��ʱB��ת����Ϊ________��
��T��ʱ���÷�Ӧ��ƽ�ⳣ��Ϊ________��
��3����TiO2ת��ΪTiCl4�ǹ�ҵұ�������ѵ���Ҫ��Ӧ֮һ��
��֪��TiO2(s)��2Cl2(g)��TiCl4(l)��O2(g)��H����140.5kJ/mol
C(s��ʯī)��![]() O2(g)��CO(g) ��H����110.5kJ/mol
O2(g)��CO(g) ��H����110.5kJ/mol
��ӦTiO2(s)��2Cl2(g)��2C(s��ʯī)��TiCl4(l)��2CO(g)����H��_______��
A����80.5kJ/mol B����30.0kJ/mol
C����30.0kJ/mol D����80.5kJ/mol
��4��Cu(OH)2��ˮ��Һ�д����ܽ�ƽ�⣺Cu(OH)2(s)![]() Cu2��(aq)��2OH��(aq)��Ksp��c(Cu2��)c2(OH��)��2��10��20������Һ�и�����Ũ���ݵij˻������ܶȻ�ʱ���������������֮������ijCuSO4��Һ��c(Cu2��)��0.02mol/L����Ҫ����Cu(OH)2������Ӧ������ҺpH��________��
Cu2��(aq)��2OH��(aq)��Ksp��c(Cu2��)c2(OH��)��2��10��20������Һ�и�����Ũ���ݵij˻������ܶȻ�ʱ���������������֮������ijCuSO4��Һ��c(Cu2��)��0.02mol/L����Ҫ����Cu(OH)2������Ӧ������ҺpH��________��
��5��ãã��ҹ�У������Ϊ����Աָ���˷�����Ƶĵ�Դ���볤Ч���ȶ����ҹ��Ƽ����������Ƴ������Ͻ�Pt��Fe�Ͻ���Ϊ�缫���ϵĺ�ˮ��ء�
�ٸõ���У���ˮ�ǵ������Һ����������_______������Ͻ𡱻�Pt��Fe�Ͻ���������
�ڸõ���и����缫��ӦʽΪ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������![]() ��һ�ֿ�������ҩ���ϳ�·�����¡�
��һ�ֿ�������ҩ���ϳ�·�����¡�
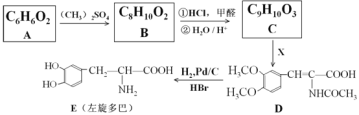
��֪����.![]() +HCl+
+HCl+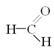 ��
��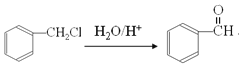
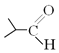
��.
![]()
![]() ��
��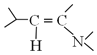 +H2O
+H2O
�ش��������⣺
��1��������X�Ľṹ��ʽ___��
��2������˵������ȷ����___��
A.������A��E�ڿ��������ױ���
B.������D��E�ɷ���ȡ����Ӧ���ӳɷ�Ӧ
C.������D���ܷ���������Ӧ�����ܷ�����ԭ��Ӧ
D.��ˮ�зֱ���뻯����D��E���ܲ�����ˮ��ɫ��ʵ��������ԭ����ͬ
��3��д��A��B��һ�������·�����Ӧ�Ļ�ѧ����ʽ��___��
��4��������C�ж���ͬ���칹�壬д������������������������ͬ���칹��___��
�ٷ������б�������1H-NMR�ױ�����������4����ԭ�ӣ����ܷ���ˮ�ⷴӦ
��5������Ա��Ͱ�������(![]() )Ϊԭ���Ʊ�
)Ϊԭ���Ʊ�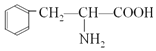 �ĺϳ�·��(������ͼ��ʾ�����Լ���ѡ)___��
�ĺϳ�·��(������ͼ��ʾ�����Լ���ѡ)___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��Al2(SO4)3��Һ�������ɲ��������յõ�������________________���ѧʽ������NaHCO3��Al2(SO4)3������Һ��Ϻ������ĭ��������ԭ����_____________________�������ӷ���ʽ��ʾ��
��2��ʵ������Һ�г���NaOH������ϴ�����ᴿ����100mL 1mol��L-1��NaOH��Һ���ձ�״����2.24LSO2ʱ��������Һ�и�����Ũ���ɴ�С��˳��Ϊ____________________________
��3��25��ʱ���������ӿ�ʼ����ʱ��pH���±���
���� | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
������ͬŨ��Cu2+��Mg2+��Fe2+����Һ�еμ�NaOH��Һʱ��_____�ȳ����������ӷ��ţ���Ҫʹ0.3mol��L-1����ͭ��Һ��Cu2+������Ϊ��ȫ����Cu2+Ũ�Ƚ���10��5 mol��L-1ʱ������Ӧ����Һ���������������Һʹ��ҺpHΪ____��KspCu(OH)2=1��10-20��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��������������ϵ�������أ�����������ȷ���ǣ� ����
A.�����ȵı���̼������Һ��ȥ��������Ŀ�����
B.��������ˮ���γɽ��壬��˿���������ˮ��ɱ������
C.ú��������Һ��������ѧ�仯���̣��ɱ�Ϊ�����Դ
D.�������ߺ����ķ������к����ķ���ϩ�����ķ���ϩ���ڲ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾװ�ã�����ģ�����ĵ绯ѧ����������˵���������(����)

A.��X��п������K��M���ӣ��˷���������������������������ʹ�������ܸ�ʴ
B.��X��̼������K��N���ӣ��ɼ������ĸ�ʴ
C.��X��̼������K��M���ӣ�̼���ĵ缫��Ӧʽ��2H����2e��=H2��
D.��X��п������K��N���ӣ�п���ĵ缫��Ӧʽ��Zn��2e��=Zn2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������Ļ��Գɷ֣����ڿ�ǻ�в������ոУ��ܹ���Ѫѹ�͵��̴��Ĺ�Ч�������ںܴ�̶���Ԥ�����ಡ��Ҳ�ܻ��⼡��ؽ���ʹ���������������Ľṹ���Ա�ʾΪ��
 ��R������
��R������
����һ���������������J�ĺϳ�·�����£�
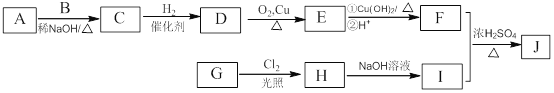
��֪��
��A��B��EΪͬϵ�����B����Է�������Ϊ44��A��B�˴Ź���������ʾ��������壻
��������J�ķ���ʽΪC15H22O4��
��
�ش��������⣺
��1��G���������ŵ�����Ϊ ��
��2����A��B����C�Ļ�ѧ����ʽΪ ��
��3����C����D�ķ�Ӧ����Ϊ ��D�Ļ�ѧ����Ϊ ��
��4����H����I�Ļ�ѧ����ʽΪ ��
��5��J�Ľṹ��ʽΪ ��
��6��G��ͬ���칹���У������ϵ�һ�ȴ���ֻ��һ�ֵĹ��� �֣����������칹�����˴Ź���������ʾ2������ ��д�ṹ��ʽ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���A����Է�������������150�� ���ⶨA�����������ʣ�
A������ | �ƶ�A����ɡ��ṹ |
����ȼ�գ�ȼ�ղ���ֻ��CO2��H2O | __________ |
��A�봼��������Ũ��������¾�����������ζ������ | __________ |
����һ�������£�A�ܷ�����������ˮ��Ӧ��������������ˮ��ϣ���ˮ��ɫ | |
��0.1 mol A������NaHCO3��Һ��Ӧ����4.48 L(��״����)���� | ___________ |
(1)��д���пհס�
(2)��A��������Ԫ�ص���������Ϊ59.7%����A�ķ���ʽΪ_______________
(3)��A��������̼֧����д����Ӧ�۵Ļ�ѧ����ʽ��_____________________��
(4)����������A��Ϊͬϵ�����________(����ĸ)��
a. ![]() b.
b. ![]()
c. ![]() d.
d. ![]()
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com