
(14分)某课外活动小组同学用图一装置进行实验,试回答下列问题。
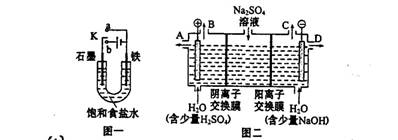
(1)① 若开始时开关K与a连接,则铁发生的是电化学腐蚀中的 腐蚀;
② 若开始时开关K与b连接,则总反应的离子方程式 。
(2)芒硝(化学式为Na2SO4·10H2O),无色晶体,易溶于水,是一种分布很广泛的硫酸盐矿物。该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法。用如图二所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是提高原料的利用率来看都更加符合绿色化学理念。
① 该电解槽的阳极反应式为: ,此时通过阴离子交换膜的离子数 (填“大于”或“小于”或“等于”)通过阳离子交换膜的离子数。
② 制得的氢氧化钠溶液从出口(选填“A”、“B”、“C”、“D”) 导出。
③ 若将制得的氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,则电池负极的电极反应式为 。已知H2的燃烧热为285.8 kJ/mol,则该燃料电池工作产生36 g H2O时,理论上有 kJ的能量转化为电能。
(1)① 吸氧
② 2Cl— +2H2O 2OH— + H2↑+
Cl2↑
2OH— + H2↑+
Cl2↑
(2)① 4OH—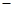 4e—=2H2O + O2↑ 小于
② D ③ H2
4e—=2H2O + O2↑ 小于
② D ③ H2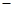 2e—+ 2OH—=2H2O
571.6
2e—+ 2OH—=2H2O
571.6
【解析】(1)① 若开始时开关K与a连接,则构成原电池,由于溶液显中性,所以发生钢铁的吸氧腐蚀。
②若开始时开关K与b连接,则构成电解池,石墨和电源的正极相连,作阳极,溶液中的氯离子放电。铁和电源的负极相连,作阴极,溶液中的氢离子放电,所以方程式为2Cl— +2H2O 2OH— + H2↑+
Cl2↑。
2OH— + H2↑+
Cl2↑。
(2)①电解池中阳极失去电子,则溶液中的OH-失去电子,方程式为 4OH—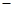 4e—=2H2O
+ O2↑。由于通过阴离子交换膜的是SO42-,而通过阳离子交换膜的是H+,所以根据电荷守恒可知,通过阴离子交换膜的离子数小于通过阳离子交换膜的离子数。
4e—=2H2O
+ O2↑。由于通过阴离子交换膜的是SO42-,而通过阳离子交换膜的是H+,所以根据电荷守恒可知,通过阴离子交换膜的离子数小于通过阳离子交换膜的离子数。
②氢氧化钠在阴极生成,所以从D处导出。
③原电池中负极失去电子,正极得到电子,所以氢气在负极通入。由于溶液是氢氧化钠溶液,因此负极电极反应式为H2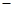 2e—+ 2OH—=2H2O。燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以生成36g水放出的热量是285.8 kJ×2=571.6kJ,即有571.6kJ的能量转化为电能。
2e—+ 2OH—=2H2O。燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以生成36g水放出的热量是285.8 kJ×2=571.6kJ,即有571.6kJ的能量转化为电能。


科目:高中化学 来源: 题型:
 某课外活动小组同学用如图装置进行实验,试回答下列问题.
某课外活动小组同学用如图装置进行实验,试回答下列问题.
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 (2008?东莞模拟)某课外活动小组同学用右图装置进行实验,试回答下列问题.
(2008?东莞模拟)某课外活动小组同学用右图装置进行实验,试回答下列问题.
| ||
| ||
 气、氧气、硫酸和氢氧化钾.
气、氧气、硫酸和氢氧化钾.查看答案和解析>>
科目:高中化学 来源: 题型:
 某课外活动小组同学用右图装置进行实验,一段时间后在C电极表面有铜析出,试回答下列问题.
某课外活动小组同学用右图装置进行实验,一段时间后在C电极表面有铜析出,试回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
 某课外活动小组同学用如图装置进行实验,试回答下列问题:
某课外活动小组同学用如图装置进行实验,试回答下列问题:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 某课外活动小组同学用右图装置进行实验,试回答下列问题.
某课外活动小组同学用右图装置进行实验,试回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com