
| A. | 苯、溴水、铁粉混合制成溴苯 | |
| B. | 加浓溴水,然后过滤可除去苯中少量苯酚 | |
| C. | 用溴水可鉴别苯、CCl4、苯乙烯 | |
| D. | 用硝酸银溶液直接检验溴乙烷中的溴元素 |
分析 A.苯与溴水不反应;
B.溴、三溴苯酚均易溶于苯;
C.溴水与苯混合分层后有机层在上层,与四氯化碳混合有机层在下层,与苯乙烯发生加成反应而褪色;
D.溴乙烷不能电离出溴离子.
解答 解:A.苯与溴水不反应,应利用苯、液溴、铁粉混合制成溴苯,故A错误;
B.溴、三溴苯酚均易溶于苯,不能除杂,应加NaOH溶液、分液除去苯中少量苯酚,故B错误;
C.溴水与苯混合分层后有机层在上层,与四氯化碳混合有机层在下层,与苯乙烯发生加成反应而褪色,现象不同,可鉴别,故C正确;
D.溴乙烷不能电离出溴离子,则不能用硝酸银溶液直接检验溴乙烷中的溴元素,应水解或消去反应后检验,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的制备、混合物分离提纯、离子检验等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:解答题
 可表示为
可表示为 ,则金刚乙烷、金刚乙胺的结构简式可用如图
,则金刚乙烷、金刚乙胺的结构简式可用如图 表示.
表示.
 +2NH3→
+2NH3→ +NH4Cl
+NH4Cl ,如金刚乙烷表示为R-CH2CH3)
,如金刚乙烷表示为R-CH2CH3)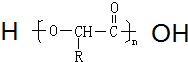 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | ⑩ | ||||||
| 2 | ⑥ | ⑦ | ||||||
| 3 | ② | ③ | ④ | ⑧ | ||||
| 4 | ⑤ | ⑨ |
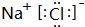 ,高温下灼烧该化合物火焰呈黄色.
,高温下灼烧该化合物火焰呈黄色.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 酒精(水) | 生石灰 | 蒸馏 |
| C | 苯(甲苯) | 酸性KMnO4溶液 | 分液 |
| D | 乙烷(乙烯) | Br2的CCl4溶液 | 洗气 |
| A. | A | B. | B | C. | C D.D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 在共价化合物中一定含有共价键 | |
| C. | 含有离子键的化合物一定是离子化合物 | |
| D. | 全部由非金属组成的化合物可能是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述I | 叙述II |
| A | 晶体硅熔点高硬度大 | 可用于制作半导体材料 |
| B | BaSO4难溶于酸 | 用硫酸和BaCl2溶液检验SO42- |
| C | NH3极易溶于水 | NH3可用于设计喷泉实验 |
| D | NaOH可以与SiO2反应 | 用NaOH溶液雕刻工艺玻璃上的纹饰 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | H2C2O4(aq) | KMnO4(H+)(aq) | MnSO4(s) 质量(g) | 褪色时间(g) | ||
| C(mo•L-1) | V(mL) | C(mol•L-1) | V(mL) | |||
| 实验1 | 0.1 | 2 | 0.01 | 4 | 0 | 30 |
| 实验2 | 0.1 | 2 | 0.01 | 4 | 5 | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 排布在K、L、M三个电子层上 | B. | 3p能级上有2个空轨道 | ||
| C. | 共有16种不同的运动状态 | D. | 共有5种不同的能级 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com