
| A. | 标准状况下,22.4L CCl4中含有的分子数为NA | |
| B. | 常温下,23g Na完全被氧化失去的电子数为NA | |
| C. | 标准状况下,22.4L CH4中含有的电子数为NA | |
| D. | 0.3mol•L-1AlCl3溶液中含有的氯离子数为0.9NA |
分析 A、标况下,四氯化碳为液体;
B、求出钠的物质的量,然后根据反应后钠元素变为+1价来分析;
C、求出甲烷的物质的量,然后根据1mol甲烷含10mol电子来分析;
D、溶液体积不明确.
解答 解:A、标况下,四氯化碳为液体,不能根据气体摩尔体积来计算其物质的量,故A错误;
B、23g钠的物质的量为1mol,而反应后钠元素变为+1价,故1mol钠失去1mol电子即NA个,故B正确;
C、标况下,22.4L甲烷的物质的量为1mol,而1mol甲烷含10mol电子即10NA个,故C错误;
D、溶液体积不明确,故溶液中含有的氯离子的个数无法计算,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,掌握公式的运用和物质的状态以及物质的结构是解题的关键.


科目:高中化学 来源: 题型:填空题
 和
和 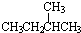 ②
② 和
和 
 与
与
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe (OH)3 | Zn(OH)2 |
| pH | 1.5~3.2 | 6.4~8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 金属钠着火燃烧时,用干燥沙土灭火 | |
| B. | 点燃可燃性气体前,都必须先检验气体的纯度 | |
| C. | 少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液擦洗 | |
| D. | 配制H2SO4溶液时,先在量筒中加一定体积的水,再在搅拌下慢慢加入浓H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2+H2O═HCl+HClO | B. | 2Na+2H2O═2NaOH+H2↑ | ||
| C. | 2F2+2H2O═4HF+O2↑ | D. | CaO+H2O═Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H<0、△S>0的反应在温度低时不能自发进行 | |
| B. | 在其他外界条件不变的情况下,使用催化剂可改变化学反应进行的方向 | |
| C. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 | |
| D. | NH4HCO3(s)═NH3 (g)+H2O(g)+CO2 (g)△H=+185.57 kJ/mol可能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com