
| A. | C5H12 | B. | 丙烯 | C. | C2H4 | D. | 乙炔 |
分析 使溴的四氯化碳溶液褪色,说明能够与溴发生加成反应,反应物分子中必须含有不饱和键,
使高锰酸钾溶液褪色,说明发生了氧化还原反应,选项中的物质具有还原性,据此进行分析即可.
解答 解:A、C5H12为戊烷,分子中不含不饱和键,化学性质稳定,不能使溴的四氯化碳溶液和高锰酸钾酸性溶液褪色,故A正确;
B、丙烯能够与溴发生加成反应,能够使高锰酸钾溶液褪色,故B错误;
C、C2H4为乙烯,乙烯分子中含有碳碳双键,能够与溴发生加成反应,能够使高锰酸钾溶液褪色,故C错误;
D、乙炔分子中含有碳碳三键,能够与溴发生加成反应,能够使高锰酸钾溶液褪色,故D错误,故选A.
点评 本题主要考查了烯烃的性质,使溴的四氯化碳溶液溶液褪色,说明能够与溴发生加成反应,反应物分子中必须含有不饱和键,使高锰酸钾溶液褪色,说明发生了氧化还原反应,本题难度不大.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | 化合物YZ3极易溶解于水 | |
| B. | Z与M可以形成共价化合物 | |
| C. | 12g14X中含有质子的物质的量为6mol | |
| D. | 由上述四种元素组成的离子化合物受热易分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液的导电性比盐酸弱 | |
| B. | 0.1mol/LCH3COOH溶液中,氢离子浓度约为0.001mol/L | |
| C. | 醋酸溶液用水稀释后,氢离子浓度下降 | |
| D. | 醋酸溶液与碳酸钙反应,缓慢放出二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
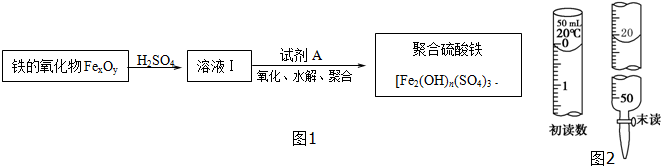
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量溶液Ⅰ于试管A、B中 | |
| 步骤2: | |
| 步骤3: |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估算化学反应的反应热(△H).
通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估算化学反应的反应热(△H).| 化学键 | Cl-Cl | H-H | H-Cl | N≡N |
| 键能/kJ•mol | 243 | 436 | 431 | 946 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验内容 | 实验目的 | |
| A | 向某未知溶液中加入BaCl2溶液后,再加入稀硝酸观察沉淀的生成 | 检验是否含SO42-离子 |
| B | 向某未知溶液中加入NaOH固体,加热,在管口用湿润的蓝色石蕊试纸检验 | 检验是否含NH4+离子 |
| C | 加热分别用SO2和HClO漂白后的品红溶液 | 探究SO2和HClO漂白原理的不同 |
| D | 加热盛有浓硫酸和铜的试管 | 探究浓硫酸的脱水性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=4的氯化铵溶液中,c(H+)=c(NH3.H2O)=1×10-4mol•L-1 | |
| B. | CH3COONa溶液中:c(Na+)>c(CH3COO-) | |
| C. | pH=2的HF溶液与pH=12的NaOH溶液体积比1:1混合:c(Na+)=c(F-)>c(H+)=c(OH-1) | |
| D. | pH相同的①NaOH ②NaClO两种溶液中水的电离程度:①=② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com