
将一小块金属钠投入到盛有100ml AlCl3和MgCl2的混合溶液的烧杯中,发现烧杯中有气泡产生,在这过程中还看到烧杯中有白色沉淀产生,沉淀物先多后少。反应完毕后,收集到标准状况下氢气13.44L同时得到21.4g沉淀,将沉淀溶于过量的NaOH溶液中,发现沉淀减少了15.6g,求原混合溶液中Mg2+、Al3+及Cl-的物质的量浓度。
Mg2+:1mol/L Al3+:3mol/L Cl-:11mol/L
解析试题分析:根据2Na+2H2O—→2NaOH+H2↑,n(H2)=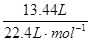 =0.6mol;n(Na)= n(NaOH)=1.2mol。
=0.6mol;n(Na)= n(NaOH)=1.2mol。
得到21.4g沉淀,将沉淀溶于过量的NaOH溶液中,发现沉淀减少了15.6g,说明Mg(OH)2是21.4g-15.6g=5.8g,n(Mg2+)=n[Mg(OH)2]=0.1mol,c(Mg2+)=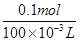 =1mol·L-1。0.1molMg2+需要0.2molNaOH。
=1mol·L-1。0.1molMg2+需要0.2molNaOH。
沉淀减少了15.6g,是Al(OH)3,为0.2mol,由反应Al(OH)3+NaOH—→NaAlO2+2H2O,此时加入0.2mol NaOH。这个实验可视为共加入1.4molNaOH。其中使全部Al3+变为NaAlO2的是1.2mol,由反应:Al3++4OH-—→AlO2-+2H2O可知,n(Al3+)=0.3mol,故c(Al3+)=3mol·L-1。
根据电荷守恒:c(Cl-)=3c(Al3+)+2 c(Mg2+)=11mol·L-1。
考点:化学反应的有关计算。考查Al3+、Mg2+在碱溶液中的反应。


科目:高中化学 来源: 题型:填空题
含 Mg2+、Al3+溶液10mL,向其中滴加a mLC1mol·L—1NaOH之后,改成滴加C2mol·L—1HCl,所得沉淀Y(mol)与加入的试剂总体积V(mL)间的关系如右图所示。据此,回答下列问题:
(1)C~D过程中的离子方程式 ;
(2)n(Mg2+)/ n(Al3+) = ;
(3)C1/C2= ;
(4)所加入NaOH溶液的体积a= mL。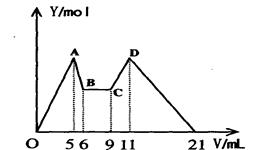
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(14分)固体A可用于工业上生产硫酸,各物质间转化如下图。其中C为红棕色粉
末,D为能使品红溶液褪色的无色气体。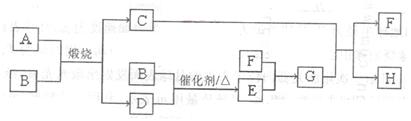
请回答:
(1)F的电子式为_________。
(2)若测得生成C和D的质量比为5:8,则A的化学式为______________。
(3)将D通入H溶液中发生反应的离子方程式为_____________。
(4)物质的量浓度均为0.lmol/L的G和H的混合溶液中,离子浓度由大到小的顺序
为____________。
(5)有人用电解某饱和溶液的方法同时制备G的浓溶液和浓氢氧化钠溶液,如图所
示。则:
①a端为电源的_________(填“正极”或“负极”)。
②N口收集的物质为__________(填化学式,下同。);
Q口收集的为_________浓溶液。
③某物质的饱和溶液最好选用___________(填试剂名称)。
④阳极的电极反应式为____________。
(6)检验H中金属阳离子的方法___________。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如下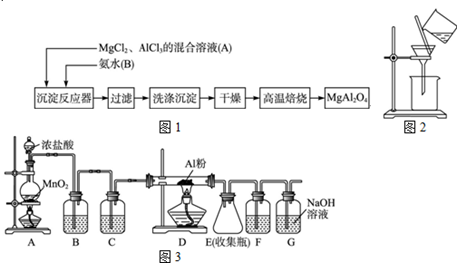
(1)为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入 (填“A”“B”或),再滴加另一反应物。制备MgAl2O4过程中,高温焙烧时发生反应的化学方程式 。
(2)如下图所示,过滤操作中的一处错误是 。
(3)判断流程中沉淀是否洗净所用的试剂是 ,高温焙烧时,用于盛放固体的仪器名称是 。
(4)无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。装置B中盛放饱和NaCl溶液,该装置的主要作用是 ,F中试剂的作用是 。用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为 ;
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
(6分)
已知:Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,能氧化浓HCl生成Cl2;PbO2不稳定,随温度升高按下列顺序逐步分解:
PbO2→Pb2O3→Pb3O4→PbO。
现将amol PbO2加热分解,收集产生的O2;向加热后所得固体中加入足量的浓盐酸,收集产生的Cl2。加热反应后所得固体中,Pb2+占Pb元素的物质的量分数为x;两步反应中收集的O2和Cl2的物质的量之和为y mol。
试回答下列问题:
⑴ 试写出Pb2O3与浓盐酸反应的化学方程式__________________________
⑵ 通过计算确定y与a、x的函数关系式____________________
⑶ 若两步反应中O2和Cl2的物质的量之比为5∶3,则剩余固体中含有的物质为____;其物质的量之比为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。
完成下列计算:
(1)叠氮化钠(NaN3)受撞击分解产生钠和氮气,故可应用于汽车安全气囊。若78克叠氮化钠完全分解,产生标准状况下氮气___________________L 。
(2)钠-钾合金可在核反应堆中用作热交换液。5.05 g钠-钾合金溶于200 mL水生成0.075 mol氢气。计算溶液中氢氧化钠的物质的量浓度______________________(忽略液体体积变化)。
(3)氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液。向该溶液中通入二氧化碳,有下列反应: 2NaAl(OH)4+CO2→2Al(OH)3↓+Na2CO3+H2O。己知通入二氧化碳112 L(标准状况下),生成的Al(OH)3和Na2CO3的物质的量之比为4:5。若向该溶液中通入的二氧化碳为224L(标准状况下),计算生成的 Al(OH)3和Na2CO3的物质的量的最大值。
(4)为测定某硫酸吸收含氨气废气后,所得铵盐中氮元素的质量分数,现将不同质量的铵盐固体分别加入到50.00mL相同浓度的氢氧化钠溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。部分测定结果如下表:
| 铵盐的质量/g | 10.00 | 20.00 | 30.00 | 50.00 |
| 浓硫酸增加的质量/g | m | m | 1.29 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(12分)铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(杂质中不含铁元素,且杂质不与H2、H2SO4反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
Ⅰ.铁矿石中含氧量的测定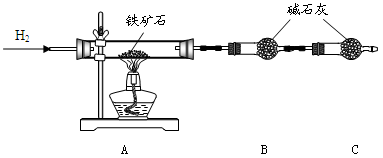
实验结果:将5.0g铁矿石放入硬质玻璃管中完全反应, 测得装置B增重1.35 g。
Ⅱ.铁矿石中含铁量的测定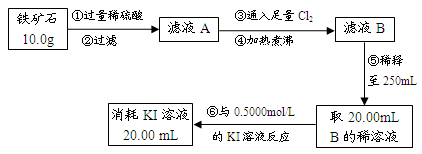
Ⅲ.问题讨论与解决:
(1)如要验证滤液A中铁元素的存在形式,可另取两份滤液A分别进行实验,实验方法、现象与结论如下表。请将其补充完整。
可供选择的试剂有:酸性KMnO4溶液、NaOH溶液、KSCN溶液、氯水
| 实验方法 | 实验现象 | 结论 |
| 步骤1:在滤液A中加入 | | 滤液A中有Fe3+ |
| 步骤2:在滤液A中加入 | | 滤液A中有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(16分)某研究小组为了探究“铁与水蒸气”的反应的产物,进行了下列实验:用如图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒高温下不与水和铁反应).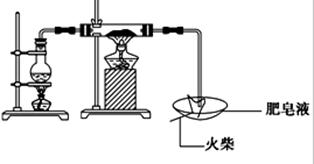
(1)如何检查该装置的气密性:
(2)写出铁与水蒸气反应的化学方程式
(3)验证固体产物中铁元素的价态
限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹;1mol/L CuSO4、3mol/L H2SO4、3mol/L HNO3、30%H2O2、0.01mol/L KMnO4、20%KSCN、蒸馏水。
在答题卡上按下表的格式写出实验步骤、预期现象与结论。
| | 实验步骤 | 预期现象与结论 |
| 步骤1 | 取反应后干燥的固体ag于试管中,加入足量的1mol/L CuSO4溶液,充分振荡,经固液分离、洗涤后,再向固体中滴加足量的 ,振荡溶解,过滤后将滤液配成250mL溶液,待用。 | |
| 步骤2 | 取少量步骤1中滤液于试管中, | |
| 步骤3 | 取少量步骤1中滤液于试管中, | |
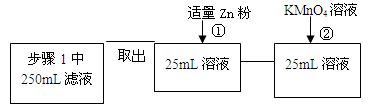
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
请根据教材上的实验“钠与氯气反应”,完成下列问题。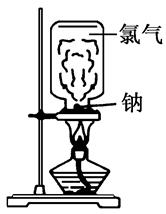
(1)取一块绿豆大的金属钠(切去氧化层),用滤纸吸净其表面的煤油,放在石棉网上,用酒精灯微热。待钠熔成球状时,将盛有氯气的集气瓶迅速倒扣在钠的上方。根据所学的知识分析该实验存在哪些缺点?
①____________________________________________________;
②____________________________________________________;
③________________。(至少填2条)
(2)某同学根据以上存在的缺点改进实验装置,如图所示: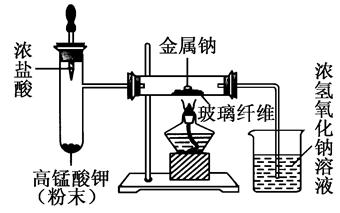
实验步骤:
a.取绿豆粒大的钠,用滤纸吸干表面的煤油,切去氧化层,放入玻璃管中,按图示安装好仪器;
b.慢慢滴加浓盐酸,立即剧烈反应产生氯气;
c.当玻璃管中充满黄绿色气体时,再加热钠,钠熔化并燃烧。
①观察到的实验现象有:当滴加浓盐酸后试管中产生________色气体;钠剧烈燃烧,火焰呈________色且有________生成,反应结束后,管壁上观察到有________生成。
②改进后的实验优点:a.________,b.________,c.______(至少回答2条)。
③写出Na在Cl2中燃烧的化学方程式________________,并用电子式表示产物形成过程________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com