
【题目】(1)物质的量表示______的集合体。
(2)物质的量的符号______;单位______;阿伏加德罗常数的符号______;单位______;通常用______表示。
(3)摩尔质量的符号______;常用单位______。
科目:高中化学 来源: 题型:
【题目】三氯化氧磷(POCl3)是一种重要的化工原料,常用作半导体掺杂剂,实验室制取POCl3并测定产品含量的实验过程如下:
I.制备POCl3采用氧气氧化液态的PCl3法。实验装置(加热及夹持装置省略》及相关信息如下。
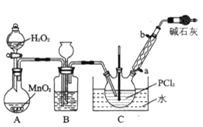
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | ―112.0 | 76.0 | 137.5 | 均为无色液体,遇水均剧烈 水解为含氧酸和氯化氢,两者互溶 |
POCl3 | 2.0 | 106.0 | 153.5 |
(1)仪器a的名称为_______________________________;
(2)装置C中生成POCl3的化学方程式为________________________________;
(3)实验中需控制通入O2的速率,对此采取的操作是_________________________________;
(4)装置B的作用除观察O2的流速之外,还有___________________________________;
(5)反应温度应控制在60~65℃,原因是__________________________________;
II.测定POCl3产品含量的实验步骤:
①实验I结束后,待三颈烧瓶中液体冷却到室温,准确称取16.725g POCl3产品,置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00mL溶液
②取10.00mL溶液于锥形瓶中,加入10.00mL 3.5mol/L AgNO3标准溶液(Ag++Cl-=AgCl↓)
③加入少量硝基苯(硝基苯密度比水大,且难溶于水)
④以硫酸铁溶液为指示剂,用0.2mol/L KSCN溶液滴定过量的AgNO3溶液(Ag++SCN-=AgSCN↓),到达终点时共用去10.00mL KSCN溶液。
(6)达到终点时的现象是_________________________________________;
(7)测得产品中n(POCl3)= ___________________________;
(8)已知Ksp(AgCl)> Ksp(AgSCN),据此判断,若取消步骤③,滴定结果将_______。(填偏高,偏低,或不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(都不为零),达到平衡时,X、Y、Z浓度分别为0.1 mol·L-1、0.3 mol·L-1和0.08 mol·L-1,则下列判断不合理的是( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(都不为零),达到平衡时,X、Y、Z浓度分别为0.1 mol·L-1、0.3 mol·L-1和0.08 mol·L-1,则下列判断不合理的是( )
A. c1∶c2=1∶3
B. 平衡时,Y和Z的生成速率之比为2∶3
C. X和Y的转化率相等
D. c1的取值范围为0<c1<0.14 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质分类的正确组合是( )
混合物 | 氧化物 | 含氧酸 | 碱 | 盐 | |
A | 空气 | SiO2 | H2SO4 | Na2CO3 | NaHCO3 |
B | 冰水混合物 | Na2O | NaHSO4 | NaOH | NaCl |
C | 水煤气 | CuO | HCl | NH3 . H2O | CaF2 |
D | 盐酸 | Na2O2 | HNO3 | Ca(OH)2 | CaCO3 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乳酸(PLA)是一种无毒性、可再生、可分解的高分子聚合物塑料,PLA早期在医学上使用,作手术缝合线及骨钉等,现在则已较广泛应用于一些常见的物品,如:包装袋、纺织纤维,PLA由植物中萃取出的淀粉(玉米、甜菜、小麦、甘薯等)或用纤维素(玉米秸秆、麦秆、甘蔗渣等木质的农业废弃物)经过下列过程制造而成:淀粉或纤维素![]() 葡萄糖
葡萄糖![]() 乳酸
乳酸![]() 聚乳酸
聚乳酸
根据上述信息,回答下列问题:
(1)淀粉水解生成葡萄糖的化学方程式为___________________________________________。
(2)已知1 mol葡萄糖![]() 2 mol乳酸,转化过程中无其他反应物、生成物,则乳酸的分子式为_______________________________。
2 mol乳酸,转化过程中无其他反应物、生成物,则乳酸的分子式为_______________________________。
(3)某研究性小组为了研究乳酸(无色液体,与水混溶)的性质,做了如下实验:
①取1.8 g乳酸与过量的饱和NaHCO3溶液反应,测得生成的气体体积为448 mL(气体体积已换算为标准状况下的体积)。
②另取1.8 g乳酸与过量的金属钠反应,测得生成的气体体积为448 mL(气体体积已换算为标准状况下的体积)。
由实验数据推知乳酸分子含有________(填官能团名称),从以上条件推知乳酸的结构简式可能为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学校实验室从化学试剂商店买回18.4 mol·L-1的硫酸。现用该浓硫酸配制
100 mL 1 mol·L-1的稀硫酸。可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平。
请回答下列问题:
(1)配制稀硫酸时,上述仪器中不需要使用的有________(选填序号),还缺少的仪器有________(写仪器名称)。
(2)配制100 mL 1 mol·L-1的稀硫酸需要用量筒量取上述浓硫酸的体积为________mL(保留一位小数),量取浓硫酸时应选用__________(选填①10 mL、②50 mL、③100 mL)规格的量筒。
(3)实验中造成所配溶液浓度偏高的原因可能是________。
A.容量瓶中原来含有少量蒸馏水
B.未经冷却,立即转移至容量瓶并洗涤烧杯,定容
C.烧杯没有洗涤
D.向容量瓶中加水定容时眼睛一直仰视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是
A. 金属钠与水反应:Na+H2O=Na++OH-+H2↑
B. NaHCO3的水解反应:HCO3-+H2O![]() CO32-+H3O+
CO32-+H3O+
C. 铁和稀HNO3反应后溶液pH=1:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
D. 向Mg(HCO3)2溶液中加入过量NaOH溶液:Mg2++2HCO3-+4OH-=Mg(OH)2↓+2CO32-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表述为2KClO3+4HCl(浓)=2KCl+Cl2↑+2ClO2↑+2H2O。
(1)请分析该反应中电子转移的情况(用双线桥表示)。_____
(2)浓盐酸在反应中显示出来的性质是________(填序号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)产生0.1molCl2,转移电子的物质的量为________mol。
(4)ClO2具有很强的氧化性,因此常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是Cl2的_
_______倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组用如图装置进行实验,试回答下列问题:

(1)若开始时开关K与a连接,则B极的电极反应为____________________。
(2)若开始时开关K与b连接,则B极的电极反应为____________________,总反应的离子方程式为____________________。
(3)有关上述实验,下列说法正确的是______。
A.溶液中Na+向A极移动
B.从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
C.反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
D.若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(4)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
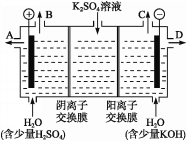
①该电解槽的阳极反应为______________。 此时通过阴离子交换膜的离子数_____(填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填“A”、“B”、“C”或 “D”)________导出。
③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com