

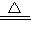 CO↑+CO2↑+3H2O;
CO↑+CO2↑+3H2O;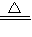 CO↑+CO2↑+3H2O;
CO↑+CO2↑+3H2O;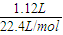 ×(5-2),两式联立解得x=0.025mol,y=0.05mol,所以Cu的质量分数为:
×(5-2),两式联立解得x=0.025mol,y=0.05mol,所以Cu的质量分数为: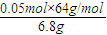 ×100%=50%,故答案为:50%.
×100%=50%,故答案为:50%.

科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 某研究性学习小组通过查阅资料发现,CuSO4溶液与NaOH溶液反应生成的沉淀中除Cu(OH)2外,还有碱式硫酸铜[化学式可表示为xCuSO4?yCu(OH)2].为了加以验证,小组成员进行了如下实验:
某研究性学习小组通过查阅资料发现,CuSO4溶液与NaOH溶液反应生成的沉淀中除Cu(OH)2外,还有碱式硫酸铜[化学式可表示为xCuSO4?yCu(OH)2].为了加以验证,小组成员进行了如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:
| 分子式 | 水溶性 | 熔点/℃ | |
| 草酸晶体 | H2C2O2?2H2O | 易溶于水 | 101.5 |
| 草酸钙 | CaC2O4 | 难溶于水 | ---- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2011届湖北省黄冈中学高三5月模拟考试(理综)化学部分 题型:实验题
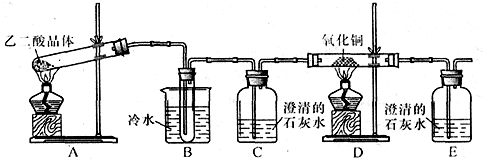
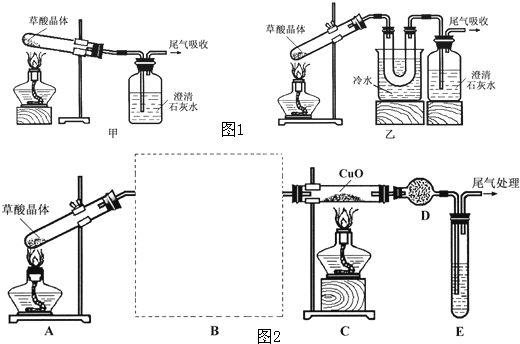
某研究性学习小组通过实验来探究乙二酸(又名草酸)受热分解的产物,他们设计的实验装置如下图所示: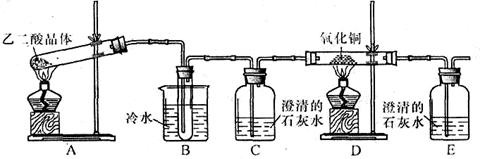
 查阅资料可知:乙二酸晶体(H2C2O4·2H2O)熔点100.1 ℃,草酸钙是难溶于水的白色固体;Cu2O能溶于稀硫酸,立即发生歧化反应生成Cu2+和Cu。
查阅资料可知:乙二酸晶体(H2C2O4·2H2O)熔点100.1 ℃,草酸钙是难溶于水的白色固体;Cu2O能溶于稀硫酸,立即发生歧化反应生成Cu2+和Cu。
(1)实验过程中观察到C、E装置中的溶液均变浑浊,且D装置中黑色粉末变为红色,写出A中发生反应的化学方程式: ;
(2)装置B的作用是 ;上述装置中有两处需要改进(假设洗气装置每次吸收气体均完全),改进方法是 ; 。
(3)实验结束后向装置B的试管中加入NaHCO3溶液,产生大量无色气体,由此可以证明两种物质的酸性强弱顺序是 。
(4)有人认为D装置中得到的红色固体可能是Cu,也可能是Cu和Cu2O的混合物。实验小组 进一步探究:
进一步探究:
①取少量红色固体加入到盛稀硫酸的试管中,充分振荡,溶液变为蓝色,试管底部仍有红色固体,由此可以得出的结论是 。
②取6.8g红色固体与足量的稀硝酸反应,收集到标准状况下的NO气体1.12L。则红色固体中含单质铜的质量分数是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com