
分析 根据质量守恒可知2n(Mg2+)+3n(Al3+)=n(Cl-)=0.2L×1.3mol/L=0.26mol,因n(Mg2+)=0.2mol/L×0.2L=0.04mol,可知n(Al3+)=0.06mol,欲使Mg2+全部沉淀分离出来,可发生Mg2++2OH-=Mg(OH)2↓,Al3++4OH-=AlO2-+2H2O,结合离子方程式计算.
解答 解:溶液中含有镁离子的物质的量为:n(Mg2+)=0.2mol/L×0.2L=0.04mol,
根据电荷守恒可知:2n(Mg2+)+3n(Al3+)=n(Cl-)=0.2L×1.3mol/L=0.26mol,
则铝离子的物质的量为:n(Al3+)=$\frac{1}{3}$(0.26mol-0.04×2)=0.06mol,
欲使Mg2+全部沉淀分离出来,可发生Mg2++2OH-=Mg(OH)2↓,Al3++4OH-=AlO2-+2H2O,
则需要强氧化钠的物质的量为:n(NaOH)=0.04mol×2+0.06mol×4=0.32mol,
需要消耗4molL的强氧化钠溶液的体积为:V(NaOH)=$\frac{0.32mol}{4mol/L}$=0.08L=80mL,
答:要使Mg2+转化为Mg(OH)2并使Mg2+、Al3+分离开来,至少需4mol/L的NaOH溶液80mL
点评 本题考查混合物反应的计算、离子方程式的计算,为高考常见题型,题目难度中等,试题侧重于学生的分析能力和计算能力的考查,根据守恒计算铝离子的物质的量为解答该题的关键.


科目:高中化学 来源: 题型:选择题
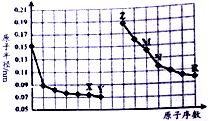
| A. | Y、R两种元素的气态氢化物稳定性大小:Y<R | |
| B. | 简单离子的半径:X>Z>M | |
| C. | 由X于N两种元素组成的化合物不能与任何酸反应,但能与强碱反应 | |
| D. | Z单质能从M与R元素构成的盐溶液中置换出单质M |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
| A. | 该反应的化学方程式是CO(g)+H2O(g)?CO2(g)+H2(g) | |
| B. | 上述反应的正反应是放热反应 | |
| C. | 增加CO,CO的平衡转化率增大 | |
| D. | 若平衡浓度符合关系$\frac{c(C{O}_{2})}{3c(CO)}$=$\frac{c({H}_{2}O)}{5c({H}_{2})}$,则此时的温度为1000℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液可保存在玻璃塞的试剂瓶中 | |
| B. | 液溴应盛放在用水密封且用玻璃塞塞紧的棕色试剂瓶中 | |
| C. | 一学生用广泛pH试纸测得某浓度的稀盐酸pH为2.3 | |
| D. | 配制硫酸亚铁溶液,是将绿矾晶体溶于蒸馏水再加入一定量的铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | V(N2)=0.2mol•L-1•min-1 | B. | V(H2)=0.1mol•L-1•min-1 | ||
| C. | V(NH3)=0.4mol•L-1•min-1 | D. | V(H2)=0.3mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在熔融电解质中,O2-由正极移向负极 | |
| B. | 电解一共生成0.9 mol气体时,理论上消耗0.1 mol丁烷 | |
| C. | 电解池的阳极反应式为4OH--4e-═2H2O+O2↑ | |
| D. | 通入空气的一极是正极,电极反应式为O2+4e-═2O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,该反应的反应类型是加成反应.
,该反应的反应类型是加成反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷分子的比例模型 | B. | 氨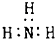 | ||
| C. | Cl-离子的结构示意图 | D. | 8个中子的碳原子的符号${\;}_{6}^{14}$C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
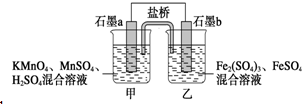 某小组将反应2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计为如图原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为2mol•L-1,溶液的体积均为200mL,盐桥中装有饱和K2SO4溶液.下列说法中错误的是( )
某小组将反应2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计为如图原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为2mol•L-1,溶液的体积均为200mL,盐桥中装有饱和K2SO4溶液.下列说法中错误的是( )| A. | 电池工作时,盐桥中的SO42-移向乙烧杯 | |
| B. | 石墨b的电极反应式为Fe2+-e-═Fe3+ | |
| C. | 当有0.1 mol SO42-进入烧杯时,反应消耗H+0.2 mol | |
| D. | 当 MnSO4浓度变为2.2 mol•L-1时,反应中转移电子0.2 mol(不考虑溶液的体积变化) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com