
【题目】元素![]() 、
、![]() 、
、![]() 在周期表中的相对位置如图所示。已知
在周期表中的相对位置如图所示。已知![]() 元素原子的外围电子排布式为
元素原子的外围电子排布式为![]() ,则下列说法不正确的是( )
,则下列说法不正确的是( )

A.![]() 元素原子的价电子排布式为
元素原子的价电子排布式为![]()
B.![]() 元素在元素周期表的第三周期第ⅥA族
元素在元素周期表的第三周期第ⅥA族
C.![]() 元素所在周期中所含非金属元素最多
元素所在周期中所含非金属元素最多
D.![]() 元素原子的核外电子排布式为
元素原子的核外电子排布式为![]()
【答案】A
【解析】
Y元素原子的外围电子排布为nsn1npn+1,s能级最多容纳2个电子,故n1=2,解得n=3,故Y元素原子的外围电子排布为3s23p4,Y为S元素,由X、Y、Z在周期表中的位置可知,X为F元素,Z为As元素。
A.Y元素原子的外围电子排布为nsn1npn+1,s能级最多容纳2个电子,故n1=2,解得n=3,故Y元素原子的外围电子排布为3s23p4,故A错误;
B.Y为S元素,处于第三周期第ⅥA族,故B正确;
C.X为F元素,处于第二周期,只有2两种金属元素,含有6种非金属元素,含非金属元素最多,故C正确;
D.Z为As元素,是33号元素,其元素原子的核外电子排布式为![]() ,故D正确;
,故D正确;
答案选A。


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
【题目】镍及其化合物是重要的合金材料和催化剂。请回答下列问题:
(1)基态镍原子的价电子排布式为___________,排布时最高能层的电子所占的原子轨道有__________个伸展方向。
(2)镍能形成多种配合物如正四面体形的Ni(CO)4 和正方形的[Ni(CN)4]2-、正八面体形的[Ni(NH3)6]2+等。下列说法不正确的有_________。
A.CO与CN-互为等电子体,其中CO分子内σ键和π键个数之比为1:2
B.NH3的空间构型为平面三角形
C.Ni2+在形成配合物时,其配位数可能为是4或6
D.Ni(CO)4中,镍元素是sp3杂化
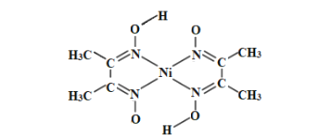
(3)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如图所示。该结构中,除共价键外还存在配位键和氢键,请在图中用“”表示出氢键。_____
(4)NiO的晶体结构类型与氯化钠的相同,相关离子半径如下表:
![]()
NiO晶胞中Ni2+的配位数为_______,NiO熔点比NaCl高的原因是_______________________。
(5)研究发现镧镍合金LaNix是一种良好的储氢材料。合金LaNix晶体属六方晶系如图a所示,其晶胞如图a中实线所示,如图b所示(其中小圆圈代表La,小黑点代表Ni)。储氢位置有两种,分别是八面体空隙(“![]() ”)和四面体空隙(“
”)和四面体空隙(“![]() ”),见图c、d,这些就是氢原子存储处。
”),见图c、d,这些就是氢原子存储处。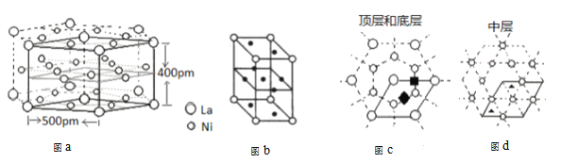
①LaNix合金中x的值为_____;
②LaNix晶胞的密度是________g/cm-3(阿伏伽德罗常数用NA表示,LaNix的摩尔质量用M表示 )
③晶胞中和“![]() ”同类的八面体空隙有______个。
”同类的八面体空隙有______个。
查看答案和解析>>
科目:高中化学 来源: 题型:
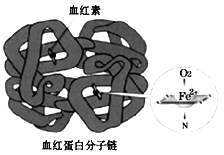
【题目】铁是人体必需的微量元素,在肺部,血红蛋白中血红素的Fe2+与O2结合,把O2送到各个组织器官。铁摄入不足可能引起缺铁性贫血。黑木耳中含有比较丰富的铁元素,某研学小组测定其含量。
(1)(铁元素的分离) 称量黑木耳,将之洗净切碎,用蒸馏水浸泡,但浸泡液中未能检测到铁元素。在坩埚中高温灼烧黑木耳,使之完全灰化。用酸充分浸泡溶解,过滤,滤液备用。
① 浸泡液检测不出铁元素的原因是____。
② 滤液中铁元素的存在形式是Fe2+、____。
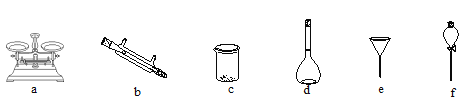
(2)(配制溶液) 将滤液配制成100 mL 溶液。实验时需要选择合适的仪器完成(铁元素的分离)、(配制溶液)2个实验,下列仪器不必使用的是____。
(3)(铁元素含量测定) 研学小组提出如下测量方案:
Ⅰ. 沉淀法:向溶液中加入足量NaOH溶液,搅拌使Fe(OH)2全部转化为Fe(OH)3然后过滤、洗涤沉淀、加热烘干、称量Fe(OH)3的质量进行分析。请指出该测量方案是否可行及其理由____。
Ⅱ. 比色法:流程示意如下:
![]()
① 用离子方程式解释加入H2O2的目的是____。
② 溶液a的颜色是____。
③ 溶液颜色越深,光的透过能力越差,即透光率越小。若不加H2O2,测出黑木耳中铁元素的含量____(填“偏大”或“偏小”)。
(4)亚铁盐易被氧化,但在体内Fe2+参与O2的运输却不被氧化。蛋白质是一种既有亲水部分、又有疏水部分的大分子,为血红素提供了疏水环境。可见,氧化还原反应能否发生与___有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中可能含有Fe2+、Al3+、![]() 、
、![]() 、
、![]() 、
、![]() 、Cl-中的若干种,现取X溶液进行连续实验,实验过程及产物如图,下列说法正确的是( )
、Cl-中的若干种,现取X溶液进行连续实验,实验过程及产物如图,下列说法正确的是( )
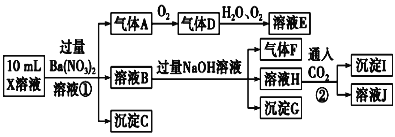
A.气体A是NO2
B.X溶液中肯定存在Fe2+、Al3+、![]() 、
、![]()
C.溶液E和气体F不能发生化学反应
D.X溶液中不能确定的离子是Al3+和Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氮及其化合物的化学用语正确的是
A.氮原子的结构示意图:![]()
B.氨气的电子式:![]()
C.铜与稀硝酸反应的离子方程式:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
D.常温时,氯化铵溶液pH<7的原因:NH4++H2O![]() NH3·H2O+H+
NH3·H2O+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图所示![]() 图中有些反应的生成物和反应的条件没有标出
图中有些反应的生成物和反应的条件没有标出![]() 。
。
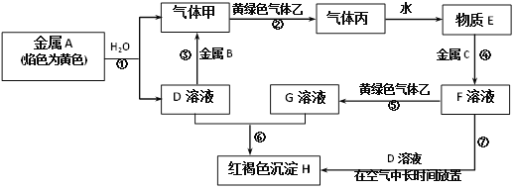
请根据以上信息完成下列各题:
(1)写出下列物质的化学式:B_______、丙__________。
(2)写出黄绿色气体乙的一种用途___________,反应过程⑦可能观察到的实验现象是______。对应的化学方程式是_______。
(3)反应③中的离子方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中通过以下反应制得:3SiO2+6C+2N2![]() Si3N4+6CO,下列说法正确的是
Si3N4+6CO,下列说法正确的是
A. 在氮化硅的合成反应中,氮气是还原剂,二氧化硅是氧化剂
B. 上述反应中每生成1 mol氮化硅,氮气得到12 mol电子
C. 该反应属于四个基本反应类型之一
D. 该反应无有毒气体产生,不需要尾气处理装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g)![]() zC(g),图Ⅰ表示200 ℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随走始n(A)∶n(B)的变化关系。则下列结论正确的是
zC(g),图Ⅰ表示200 ℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随走始n(A)∶n(B)的变化关系。则下列结论正确的是
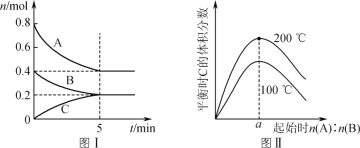
A.200 ℃时,反应达平衡时的平均速率v(B)=0.002 mol·(L·min)-1
B.图Ⅱ所知反应xA(g)+yB(g)![]() zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2
C.若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆)
D.200 ℃时,向容器中充入2 mol A和1 mol B,达到平衡时,A的体积分数小于0.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧、硫、硒(Se)、碲(Te)、钋(Po)是元素周期表中原子序数依次增大的同主族元素。回答下列问题:
(1)硒在元素周期表中的位置________。
(2)![]() Po的中子数为________。
Po的中子数为________。
(3)某温度时,该族单质与H2反应生成气态H2X的热化学方程式如下:
O2(g)+2H2(g)=2H2O(g) △H1=-484 kJ/mol
S(g)+H2(g)![]() H2S(g) △H2=-20 kJ/mol
H2S(g) △H2=-20 kJ/mol
Se(g)+H2(g)![]() H2Se(g) △H3=+81kJ/mol
H2Se(g) △H3=+81kJ/mol
①硫和硒氢化物的热稳定性:H2S________ H2Se(填“>”、“=”或“<”);判断依据是________。
②写出O2(g)与H2S(g)反应生成H2O(g)和S(g)的热化学方程式________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com