
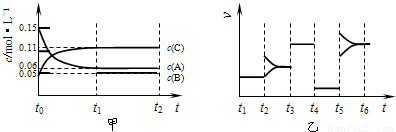
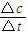 计算反应速率v(C);
计算反应速率v(C);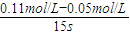 =0.004mol?L-1?s-1,故A正确;
=0.004mol?L-1?s-1,故A正确; B(g)+2C(g),根据方程式可知消耗0.09mol/L的A,则生成0.03mol/L的B,容器的体积为
B(g)+2C(g),根据方程式可知消耗0.09mol/L的A,则生成0.03mol/L的B,容器的体积为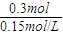 =2L,生成B的物质的量为0.03mol/L×2L=0.06mol,平衡时B的物质的量为0.05mol/L×2L=0.1mol,所以起始时B的物质的量为0.1mol-0.06mol=0.04mol,故C错误;
=2L,生成B的物质的量为0.03mol/L×2L=0.06mol,平衡时B的物质的量为0.05mol/L×2L=0.1mol,所以起始时B的物质的量为0.1mol-0.06mol=0.04mol,故C错误; B(g)+2C(g),故D正确.
B(g)+2C(g),故D正确.

科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解



 (1)A的起始物质的量为
(1)A的起始物质的量为查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| Cu2O |
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| t | 2 |
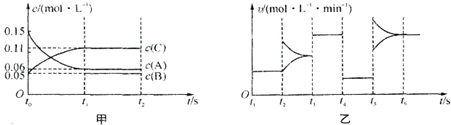
| A、若t0=15 s,则用C的浓度变化表示的t0~t1段的平均反应速率为0.004mol?L-1?s-1 |
| B、t4~t5阶段改变的条件一定为减小压强 |
| C、该容器的容积为2 L,B的起始物质的量为0.02 mol |
| D、t5~t6如阶段,容器内A的物质的量减少了0.03 mol,而此过程中容器与外界的热交换总量为a kJ,该反应的热化学方程式为3A(g)?B(g)+2C(g)△H=+100akJ?mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com