
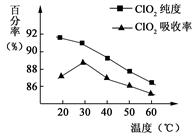
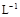 (NH4)2Fe(SO4)2 溶液充分反应,过量Fe2+再用0.0500 mol·
(NH4)2Fe(SO4)2 溶液充分反应,过量Fe2+再用0.0500 mol·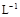 K2Cr2O7标准溶液滴定至终点,消耗20.00 mL。反应原理如下:
K2Cr2O7标准溶液滴定至终点,消耗20.00 mL。反应原理如下: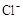 +5Fe3+ +2H2O 14H+ +
+5Fe3+ +2H2O 14H+ +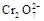 +6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O
+6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O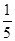 ×1.25×10-2mol=2.5×10-3mol
×1.25×10-2mol=2.5×10-3mol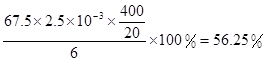
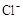 +5Fe3+ +2H2O 14H+ +
+5Fe3+ +2H2O 14H+ +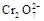 +6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O可结合电子得失守恒可得1×n(Fe2+)=5×n(ClO2)+2×3×n(Cr2O72-).与K2Cr2O7反应的n(Fe2+)=6n(Cr2O72-)=6×20×10-3L×0.0500mol/L=6×10-3mol;与ClO2反应的n(Fe2+)=37×10-3L× 0.0500mol/L -6×10-3mol=1.25×10-2mol。所以n(ClO2)=
+6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O可结合电子得失守恒可得1×n(Fe2+)=5×n(ClO2)+2×3×n(Cr2O72-).与K2Cr2O7反应的n(Fe2+)=6n(Cr2O72-)=6×20×10-3L×0.0500mol/L=6×10-3mol;与ClO2反应的n(Fe2+)=37×10-3L× 0.0500mol/L -6×10-3mol=1.25×10-2mol。所以n(ClO2)=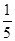 ×1.25×10-2mol=2.5×10-3mol。ClO2的“产率”=
×1.25×10-2mol=2.5×10-3mol。ClO2的“产率”=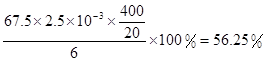 。
。

科目:高中化学 来源:不详 题型:单选题
| A.漂白粉露置在空气中:ClO-+CO2+H2O=HClO+HCO3- |
| B.用少量氨水吸收二氧化硫:SO2+NH3·H2O=HSO3-+NH4+ |
| C.少量CO2通入苯酚钠溶液:2C6H5O-+ CO2 + H2O →2C6H5OH + CO32- |
| D.磁性氧化铁(Fe3O4)溶于氢碘酸:Fe3O4 + 8H+= Fe2+ + 2Fe3+ + 4H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.MnO2与浓盐酸反应制Cl2:MnO2+4HCl Mn2++2Cl-+Cl2↑+2H2O Mn2++2Cl-+Cl2↑+2H2O |
B.明矾溶于水产生Al(OH)3胶体:Al3++3H2O Al(OH)3↓+3H+ Al(OH)3↓+3H+ |
C.Na2O2溶于水产生O2:Na2O2+H2O 2Na++2OH-+O2↑ 2Na++2OH-+O2↑ |
D.Ca(HCO3)2溶液与少量NaOH溶液反应: HC+Ca2++OH- CaCO3↓+H2O CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.HCO3-水解的离子方程式:HCO3-+H2O CO32-+H3O+ CO32-+H3O+ |
B.碘水中通入适量的SO2:I2+SO2+2H2O===2I-+SO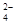 +4H+ +4H+ |
| C.过量的SO2通入NaOH溶液中:SO2—+2OH—=SO32—+H2O |
D.硝酸银溶液中滴加过量氨水:Ag++NH3·H2O===AgOH↓+NH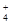 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

A.a曲线表示的离子方程式为: +H++H2O +H++H2O Al(OH)3↓ Al(OH)3↓ |
| B.b和c曲线表示的离子反应是相同的 |
| C.M点时,溶液中沉淀的质量为3.9 g |
D.原混合溶液中的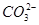 与 与 的物质的量之比为1∶2 的物质的量之比为1∶2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.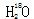 中投入Na2O2固体: 中投入Na2O2固体: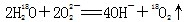 |
| B.向0.1 mol·L-1、pH=1的NaHA溶液中加入NaOH溶液:H++OH- =H2O |
| C.以金属银为阳极电解饱和硫酸铜溶液:Cu2++2H2O=2Cu+O2↑+4H+ |
D.NH4Al(SO4)2溶液中加入Ba(OH)2溶液使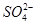 完全沉淀:Al3++2 完全沉淀:Al3++2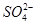 +2Ba2++4OH-= +2Ba2++4OH-=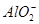 +2BaSO4↓+2H2O +2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.漂白粉露置在空气中失效:ClO-+CO2+H2O=HClO+HCO3- |
| B.氢氧化钡溶液与硫酸氢钠溶液反应后溶液恰好为中性:Ba2++H++SO42-+OH-=BaSO4↓+H2O |
| C.Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑ |
| D.在强碱性溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:4OH-+3ClO-+2Fe(OH)3=2FeO42-+3Cl-+5H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向酸化的FeSO4中加入H2O2溶液:2Fe2++2H++H2O2 =2Fe3++2H2O |
| B.向NaHCO3溶液中加入足量Ba(OH)2的溶液:Ba2++2HCO3-+2OH-=2H2O+BaCO3↓+ CO32- |
| C.向苯酚钠溶液中通入少量的CO2:2C6H5O-+CO2+H2O—→2C6H5OH+CO32- |
| D.向NaOH溶液中滴加少量氯化铝溶液:Al(OH)3+3OH-=Al(OH)3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com