
| ||
| ||
| ||
| ||
| ||
| ||
| ||
 ,故答案为:
,故答案为: .
.

科目:高中化学 来源:2012-2013学年北京市房山区高三第二次模拟化学试卷(解析版) 题型:实验题
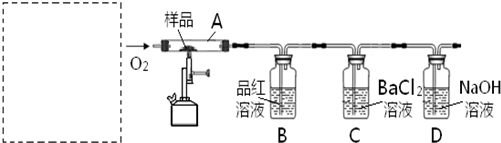
资料显示:在煤中加入适量石灰石粉可使煤(含S)燃烧时产生的SO2转化成固体CaSO4 ,从而减少SO2排放,该方法被称为钙基固硫。这一过程是通过以下两步反应实现的:
㈠ CaCO3 CaO+CO2 ㈡ 2CaO+2SO2+O2 =2CaSO4
CaO+CO2 ㈡ 2CaO+2SO2+O2 =2CaSO4
对此,某实验小组利用下列实验装置和药品对其可行性进行了模拟探究。

已知实验所用样品:Ⅰ---S粉与CaCO3粉末的混合物
Ⅱ---CaSO4 粉末
(1)实验一:①取样品Ⅰ装入A中。连续通入过量O2,加热至500℃左右,充分反应发现,B中红色消失、C中出现大量白色浑浊。停止该步实验的正确操作是 。
②取反应后D中溶液滴加过量盐酸,无明显现象。由此得知实验一过程中: A中发生反应的化学方程式是 ;C中反应的离子方程式是 。
③要获得与以上实验事实相一致的结论,可替代B中品红溶液的是 。
a.酚酞的NH3·H2O溶液 b.酸性KMnO4溶液
c.酚酞的NaHCO3溶液 d.Br2的CCl4溶液
(2)实验二:①取样品Ⅰ装入A中。连续通入过量O2,并迅速加热升温,控制在1000℃左右,充分反应。发现B中红色消失,C中出现白色浑浊。
②取反应后D中溶液滴加过量盐酸,出现大量无色气泡,反应的离子方程式是 。
③反应结束后,将A中余下固体溶入水中,取其上层清液,滴加BaCl2溶液,立即有白色沉淀出现。
由此得知实验二: A中发生的反应有 (填选 “㈠”、“㈡”)。
(3)实验三:取样品Ⅱ装入A中。连续通入过量O2,加热至1200℃左右,充分反应,B中红色消失,则A中发生反应的化学方程式是 。比较实验一、二、三可知,如用该方法固硫,可行的基本条件是 。
(4)在中学化学实验室里,装置A通常只能选 为材料制作的玻璃管,但这种选择有一点不妥,其理由用化学方程式解释是: 。
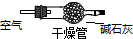
(5)实验所需O2若改由空气提供,且对上述实验探究事实不产生影响,应在A前添加一装有某药品的装置。请将该药品和装置图示在图中的虚线框内。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CaO+CO2 ㈡2CaO+2SO2+O2=2CaSO4
CaO+CO2 ㈡2CaO+2SO2+O2=2CaSO4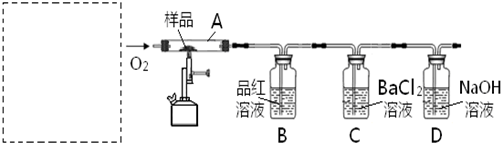
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com