
| A. | △H2>0 | |
| B. | △H3>△H1 | |
| C. | Mn+SO2═MnO2+S△H=△H2-△H1 | |
| D. | MnO2(s)+SO2(g)═MnSO4(s)△H═△H3-△H2-△H1 |
分析 A.硫与氧气反应属于放热反应;
B.反应放出热量多少未知,无法判断△H3和△H1大小;
C.①Mn(s)+O2(g)═MnO2(s)△Hl;②S(s)+O2(g)═SO2(g)△H2,①-②得:Mn+SO2═MnO2+S,依据盖斯定律计算焓变;
D.①Mn(s)+O2(g)═MnO2(s)△Hl
②S(s)+O2(g)═SO2(g)△H2
③Mn(s)+S(s)+2O2(g)═MnSO4(s)△H3
则③-①-②得:MnO2(s)+SO2(g)═MnSO4(s),依据盖斯定律计算焓变值.
解答 解:A.硫与氧气反应属于放热反应,放热反应焓变值小于0,给S(s)+O2(g)═SO2(g)△H2<0,故A错误;
B.反应放出热量多少未知,无法判断△H3和△H1大小,故B错误;
C.Mn(s)+O2(g)═MnO2(s)△Hl;②S(s)+O2(g)═SO2(g)△H2,①-②得:Mn+SO2═MnO2+S,依据盖斯定律得:Mn+SO2═MnO2+S△H=△H1-△H2,且热化学方程式应注明反应物、生成物状态,故C错误;
D..①Mn(s)+O2(g)═MnO2(s)△Hl
②S(s)+O2(g)═SO2(g)△H2
③Mn(s)+S(s)+2O2(g)═MnSO4(s)△H3
则③-①-②得:MnO2(s)+SO2(g)═MnSO4(s),依据盖斯定律得:△H═△H3-△H2-△H1,故D正确;
故选:D.
点评 本题考查了反应热的计算,熟悉盖斯定律是解题关键,题目难度中等.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
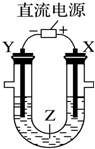
| A. | 氯碱工业中,X电极上反应式是4OH--4e-═2H2O+O2↑ | |
| B. | 电解精炼铜时,Z溶液中的铜离子浓度不变 | |
| C. | 在铁片上镀铜时,Y是纯铜 | |
| D. | 电解水制氢气时,Z可以是稀硫酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH+HCl═NaCl+H2O | B. | CuO+H2SO4═CuSO4+H2O | ||
| C. | Zn+2H+═Zn2++H2↑ | D. | CaO+H2O═Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
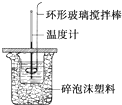 利用如图所示装置测定中和热的实验步骤如下:
利用如图所示装置测定中和热的实验步骤如下:| 温度 实验次数 | 超始温度t1℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | / |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com