
【题目】(1)在微生物作用的条件下,NH4+经过两步反应被氧化成 NO3-。两步反应的能量变化示意图如下:
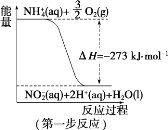

①第一步反应是_________________(填“放热”或“吸热”)反应,判断依据是___________。
②1 mol NH4+ (aq)全部氧化成NO3- (aq)的热化学方程式是_________________。
(2)已知红磷比白磷稳定,则反应 P4(白磷,s)+5O2(g)===2P2O5(s)ΔH1;4P(红磷,s)+ 5O2(g)===2P2O5(s)ΔH2;ΔH1 和 ΔH2 的关系是 ΔH1____________ΔH2(填“>”、“<”或“=”)。
(3)在 298 K、101 kPa 时,已知:2H2O(g)===O2(g)+2H2(g)ΔH1;Cl2(g)+H2(g)===2HCl(g) ΔH2;2Cl2(g)+2H2O(g)===4HCl(g)+O2(g)ΔH3
则 ΔH3 与 ΔH1 和 ΔH2 之间的关系正确的是___________。
A ΔH3=ΔH1+2 ΔH2 B ΔH3=ΔH1+ΔH2
C ΔH3=ΔH1-2ΔH2 D ΔH3=ΔH1-ΔH2
(4)已知 H2(g)+Br2(l)===2HBr(g)ΔH=-72 kJ·mol-1,蒸发 1 mol Br2(l)需要吸收的能量为 30 kJ,其他相关数据如下表:
物质 | H2(g) | Br2(g) | HBr(g) |
1 mol 分子中的化学键断裂时需要吸收的能量(kJ) | 436 | 200 | a |
则表中 a=__________________。
【答案】放热 ΔH<0(或反应物的总能量大于生成物的总能量) ![]() (aq)+2O2(g)===NO
(aq)+2O2(g)===NO![]() (aq)+2H+(aq)+H2O(l) ΔH=-346 kJ·mol-1 < A 369
(aq)+2H+(aq)+H2O(l) ΔH=-346 kJ·mol-1 < A 369
【解析】
(1)①有图可知:焓变小于0,即反应物的总能量大于生成物的总能量,所以该反应为放热反应,故答案为:放热,ΔH<0(或反应物的总能量大于生成物的总能量)。
②第一步的热化学方程式为①NH4+(aq)+1.5O2(g)=NO2-(aq)+2H+(aq)+H2O(l) ΔH=-273kJ/mol,第二步的热化学方程式为②NO2-(aq) +0.5O2(g)=NO3-(aq) ΔH=-73kJ/mol,根据盖斯定律,由①+②可得:NH4+(aq)+2O2(g)=2H+(aq)+H2O(l)+NO3-(aq) ΔH=(-273kJ/mol)+(-73kJ/mol)=-346kJ·mol-1,故答案为:NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l) ΔH=-346 kJ·mol-1。
(2)①P4(白磷,s)+5O2(g)=2P2O5(s) ΔH1,②4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2,由盖斯定律②-①可得到反应:4P(红磷,s)=P4(白磷,s) ΔH=ΔH2-ΔH1,红磷比白磷稳定,说明红磷的能量低于白磷,该反应是吸热反应,即ΔH=ΔH2-ΔH1>0,即ΔH1<ΔH2,故答案为:<。
(3)已知:①2H2O(g)=O2(g)+2H2(g) ΔH1;②Cl2(g)+H2(g)=2HCl(g) ΔH2;③2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3,则反应③=②×2+①,由盖斯定律可知:ΔH3=ΔH1+2ΔH2,故选A,故答案为:A。
(4)已知H2(g)+Br2(l)=2HBr(g) ΔH=-72kJ·mol-1,蒸发1molBr2(l)需要吸收的能量为30kJ,则H2(g)+Br2(g)=2HBr(g) ΔH=-102kJ·mol-1,ΔH=反应物键能-生成物键能,则有-102=436+200-2a,解得a=369,故答案为:369。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】N2H4·H2O(水合肼)极毒且不稳定,100℃以上易分解失水,常用作还原剂和除氧剂(通常生成N2和H2O),其熔点为-40℃,沸点118.5℃。现以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O和无水Na2SO3,其主要流程如下:
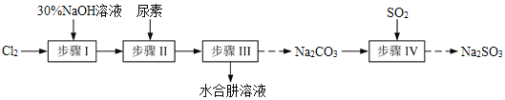
已知:Cl2(g)+2OH-(aq)=ClO-(aq)+Cl-(aq)+H2O(aq) △H<0
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒、烧杯外,还需要_____________(填标号)。
A.容量瓶 B.胶头滴管 C.玻璃棒 D.锥形瓶
(2)步骤Ⅰ制备NaClO溶液时,若温度超过40℃,Cl2与NaOH溶液充分反应生成NaClO3和NaCl。实验中为控制反应温度除了用冰水浴、充分搅拌外,还需采取的措施是_______________________。
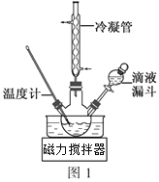
(3)步骤Ⅱ合成N2H4·H2O的装置如图1所示。NaClO碱性溶液与尿素水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。实验中通过滴液漏斗滴加的溶液是_____________(填字母);
a.尿素溶液 b.NaClO碱性溶液 c.尿素溶液或NaClO溶液任选其一
理由是____________________________________。
(4)步骤Ⅲ中分离出N2H4·H2O应该采用的方法最合理是____________________。
(5)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、HSO3-、SO32-随pH的分布如图2所示,Na2SO3的溶解度曲线如图3所示)。
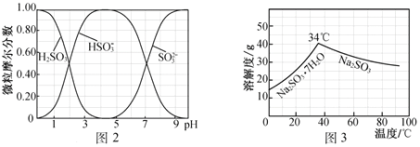
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的方法是______________。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案:_________________________________,用少量无水乙醇洗涤,干燥,密封包装。
(6)工业上还可以用水合肼还原法制取碘化钠,工艺流程如图:
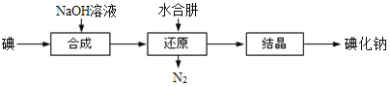
还原过程中可用硫化钠或铁屑等物质替代水合肼,但水合肼还原法制得的产品纯度更高,原因是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH![]() 、Cl-、Mg2+、Ba2+、CO
、Cl-、Mg2+、Ba2+、CO![]() 、SO
、SO![]() ,现取三份100 mL该溶液进行如下实验:
,现取三份100 mL该溶液进行如下实验:
(1) 第一份加入AgNO3溶液有沉淀产生;
(2) 第二份加足量NaOH溶液加热后,收集到气体0.04 mol;
(3) 第三份加足量BaCl2溶液后,干燥后得沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。根据上述实验,以下推测正确的是( )
①K+一定存在;②100 mL溶液中含0.01 mol CO![]() ;③Cl-可能存在;
;③Cl-可能存在;
④Ba2+一定不存在;⑤Mg2+可能存在
A. ③④ B. ③④⑤
C. ①② D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是![]()
![]()
A. ![]() 、
、![]() 、
、![]() 中,所有原子都满足最外层8电子的稳定结构
中,所有原子都满足最外层8电子的稳定结构
B. 在元素周期表中金属和非金属交界处可以找到半导体材料
C. 由非金属元素组成的化合物一定是共价化合物
D. 第ⅠA族元素和第ⅦA族元素的原子之间都能形成离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入 1mol N2, 右边充入 CO 和 CO2 的混合气体共 8g 时,隔板处于如图位置(保持温度不变),下列说法正确的是
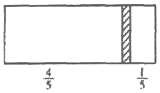
A. 右边 CO 与 CO2 分子数之比为 1:3
B. 右侧 CO 的质量为 2.75g
C. 若改变右边 CO 和 CO2 的充入量而使隔板处于离右端1/6处, 保持温度不变,则前后两次充入容器内的气体压强之比为 5: 3
D. 右侧气体密度是相同条件下氢气密度的 16 倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,可逆反应2NO2(g) ![]() 2NO(g)+O2(g)在体积固定的密闭容器中反应,达到平衡状态的标志是 ①单位时间内生成nmolO2,同时生成2nmolNO2;②单位时间内生成nmolO2,同时生成2nmolNO;③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1;④混合气体的压强不再改变;⑤混合气体的颜色不再改变;⑥混合气体的平均相对分子质量不再改变。
2NO(g)+O2(g)在体积固定的密闭容器中反应,达到平衡状态的标志是 ①单位时间内生成nmolO2,同时生成2nmolNO2;②单位时间内生成nmolO2,同时生成2nmolNO;③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1;④混合气体的压强不再改变;⑤混合气体的颜色不再改变;⑥混合气体的平均相对分子质量不再改变。
A. ①④⑤⑥ B. ①③④⑥ C. ①②③⑤ D. ②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
① CO(g)+2H2(g)![]() CH3OH(g) ΔH1 =-99kJ·mol-1
CH3OH(g) ΔH1 =-99kJ·mol-1
② CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
③ CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
(1)CO2的电子式是________________。
(2)ΔH3=______kJ·mol-1,②反应正向的熵变ΔS______0(填“>”“<”或“=”)。
(3)在容积为2 L的密闭容器中,充入一定量CO2和H2合成甲醇(上述②反应),在其他条件不变时,温度T1、T2对反应的影响图像如图。
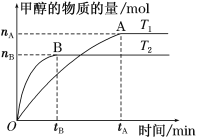
①温度为T1时,从反应到平衡,生成甲醇的平均速率为v(CH3OH)=_____ mol·L-1·min-1。
②图示的温度T1______T2(填写“>”、“<”或“=”)
(4)T1温度时,将2 mol CO2和6 mol H2充入2 L密闭容器中,充分反应(上述②反应)达到平衡后,若CO2转化率为50%,此时容器内的压强与起始压强之比为________;反应②在该温度达到平衡时,其平衡常数的数值为_______。
(5)若反应②在原电池条件下实现,请写出酸性条件下惰性电极上由CO2生成CH3OH的电极反应式:____________________,该电极为原电池的_______极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关焰色反应的实验操作及注意事项正确的是( )
A.只有把盐配制成溶液才能进行焰色反应
B.实验时用铂丝直接蘸取药品在酒精灯上灼烧
C.可以用铁丝代替铂丝进行焰色反应
D.实验后要用稀硫酸将铂丝洗净
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com