
| A、100 mL 2 mol/L的盐酸与锌反应时,加入3mol/L的稀硝酸溶液,生成氢气的速率加快 |
| B、用锌片和稀硫酸反应制取氢气,加入足量的硫酸铜溶液一定可以加快产生氢气的速率 |
| C、在做草酸与高锰酸钾的反应时,加入少量硫酸锰作催化剂可加快溶液褪色速率 |
| D、汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,若升高温度,则吸热反应速率增大,放热反应速率减小 |


科目:高中化学 来源: 题型:
| A、①②③④ | B、①③④⑥ |
| C、①③④ | D、①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、降低体系温度 |
| B、恒容,充入N2 |
| C、恒容,充入He |
| D、恒压,充入He |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、还原性 | B、氧化性 |
| C、碱性 | D、酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
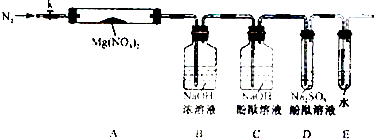 固体硝酸盐加热易分解且产物较复杂.某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想:
固体硝酸盐加热易分解且产物较复杂.某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com