
为清理路面积雪人们使用了一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 mol XY2含有54 mol电子。
(1)该融雪剂的化学式是________,该物质中化学键类型是________,电子式是________。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是________;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8e-稳定结构,该分子的结构式为________,电子式为________,化学键类型为________(填“离子键”“非极性共价键”或“极性共价键”)。
(3)W是与D同主族的短周期元素,Z是第三周期金属性最强的元素,Z的单质在W的常见单质中反应时有两种产物:不加热时生成______,其化学键类型为________;加热时生成______,其化学键类型为________,电子式为________。
科目:高中化学 来源: 题型:填空题
四种短周期元素在周期表中的位置如图,其中只有M为金属元素。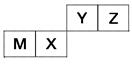
请回答下列问题:
(1)这些元素的氢化物中,水溶液碱性最强的是________(写化学式),该氢化物的电子式为________。
(2)元素X和元素Y的最高价氧化物对应水化物的酸性较弱的是________,列举一个化学方程式证明________________________。
(3)元素Z与元素M组成的化合物中所含化学键类型为________,元素Z与元素X组成的化合物中所含化学键类型为________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z三种主族元素的单质在常温下都是常见的无色气体,在适当条件下,三者之间可以两两发生反应生成分别是双核、三核和四核的甲、乙、丙三种分子,且乙、丙分子中含有X元素的原子个数比为2∶3。请回答下列问题:
(1)元素X的名称是________,丙分子的电子式为________。
(2)若甲与Y单质在常温下混合就有明显现象,则甲的化学式为________。丙在一定条件下转化为甲和乙的反应方程式为___________________________。
(3)化合物丁含X、Y、Z三种元素,丁是一种常见的强酸,将丁与丙按物质的量之比1∶1混合后所得物质戊的晶体结构中含有的化学键为________(选填序号)。
a.只含共价键 b.只含离子键 c.既含离子键,又含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | | | | ① | ② | ③ | | |
| 3 | ④ | | ⑤ | | | ⑥ | ⑦ | ⑧ |
| 4 | ⑨ | | | | | | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族;其中只有两种为金属;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9;单质Y和W都可与浓的NaOH溶液反应。请回答下列问题:
(1)Y、Z、W的原子半径由小到大的顺序是________(用元素符号表示)。
(2)ZW2的分子式为________________。
(3)工业生产单质Y的原理是__________________(用化学方程式表示)。
(4)X与Y化学性质相似,则X与浓的NaOH溶液反应的化学方程式是___________________________________________________。
(5)0.1 mol的单质W与50 mL 1.5 mol·L-1的FeBr2溶液反应,则被氧化的Fe2+和Br-的物质的量之比是______。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有A、B、C、D四种元素,A的最高正价与其负价的绝对值之差为6;A、D次外层都是8个电子,A与D的化合物DA在水溶液中能电离出具有相同电子层结构的阴、阳离子;B有两个电子层,其最高正价与最低负价的代数和为零;C2-与氩原子具有相同的电子层结构。
(1)试写出上述各元素的符号:
A________,B________,C________,D________。
(2)画出下列粒子的结构示意图:
A_________________,C2-_________________。
(3)写出A、D的最高价氧化物对应水化物反应的化学方程式:__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、W四种短周期元素在元素周期表的位置如图。其中W的原子序数是Y的2倍。
(1)W离子的结构示意图为____________。
(2)X的最简单氢化物与Cl2发生取代反应的化学方程式为(写一个)________________。
(3)能证明X、Z两元素非金属性强弱的离子方程式为__________________________。
(4)一定条件下,在密闭容器中,充入一定量的XY2(g)和XY (g),发生反应:
WY2(g)+2XY(g)  2XY2 (g)+W(1)。T1oC时,各物质的平衡浓度如下表:
2XY2 (g)+W(1)。T1oC时,各物质的平衡浓度如下表:
②若温度升高到T2oC时,反应的平衡常数为6.64,则该反应的正反应为_______反应(填 “吸热”或“放热”)。
(5)① 25℃、101 kPa,l mol金属镁完全燃烧放出300.0 kJ热量,1 mol单质X完全燃烧放出393.5 kJ热量。金属镁与X的最高价氧化物反应的热化学方程式为_________。
②室温下,Mg(OH) 2饱和溶液_________(填“能”或“不能”)使酚酞试液变红,通过计算说明原因(已知:Ksp[Mg(OH) 2]=4.0×10-12)。答__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
部分中学化学常见元素原子结构及性质如下表所示:
| 序号 | 元素 | 结构及性质 |
| ① | A | A单质是生活中的常见金属,它有两种氯化物,相对分子质量相差35.5 |
| ② | B | B原子最外层电子数是内层电子总数的1/5 |
| ③ | C | C是常见化肥的主要元素,单质常温下呈气态 |
| ④ | D | D单质被誉为“信息革命的催化剂”,是常用的半导体材料 |
| ⑤ | E | 通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物 |
| ⑥ | F | F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。
①Mn2+基态的电子排布式可表示为________。
②NO3—的空间构型是________(用文字描述)。
(2)在铜锰氧化物的催化下,CO被氧化为CO2,HCHO被氧化为CO2和H2O。
①根据等电子体原理,CO分子的结构式为________。
②H2O分子中O原子轨道的杂化类型为________。
③1 mol CO2中含有的σ键数目为________。
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为_______________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com