为测定某有机化合物A的结构,进行如下实验.
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4gH2O和8.8gCO2,消耗氧气6.72L(标准状况下).则该物质中各元素的原子个数比是 ;
(2)质谱仪测定有机化合物的相对分子质量为46,则该物质的分子式是 ;
(3)根据价键理论,预测A的可能结构并写出结构简式 ;
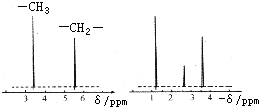
(4)有机物A分子中有三种不同化学环境的氢原子,则A的结构简式为 .
(5)A在一定条件下脱水可生成B,B可合成包装塑料C,请写出B转化为C的化学反应方程式: .
(6)体育比赛中当运动员肌肉扭伤时,队医随即用氯乙烷(沸点为12.27℃)对受伤部位进行局部冷冻麻醉.请用B选择合适的方法制备氯乙烷,要求原子利用率为100%,请写出制备反应方程式: .
(7)A可通过粮食在一定条件下制得,由粮食制得的A在一定温度下密闭储存,因为发生一系列的化学变化而变得更醇香.请写出最后一步反应的化学方程式: .
【答案】
分析:(1)n(CO
2)=
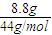
=0.2mol,n(H
2O)=
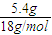
=0.3mol,n(O
2)=
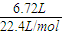
=0.3mol,结合质量守恒定律推断;
(2)质谱仪测定有机化合物的相对分子质量为46,结合最简式判断分子式为C
2H
6O;
(3)A可能为乙醇或二甲醚;
(4)有机物A分子中有三种不同化学环境的氢原子,应为乙醇,二甲醚只有一种不同化学环境的氢原子;
(5)A在一定条件下脱水可生成B,B为CH
2=CH
2,B可合成包装塑料C,C为聚乙烯;
(6)原子利用率为100%,可用加成方法制备;
(7)反应为乙酸与乙醇的酯化反应.
解答:解:(1)n(CO
2)=
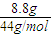
=0.2mol,n(H
2O)=
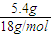
=0.3mol,n(O
2)=
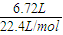
=0.3mol,则有机物中含n(O)=0.2mol×2+0.3mol-0.6mol=0.1mol,则有机物中N(C):N(H):N(O)=0.2mol:0.6mol:0.1mol=2:6:1,
最简式为C
2H
6O,
故答案为:n(C):n(H):n(O)=2:6:1;
(2)最简式为C
2H
6O,有机化合物的相对分子质量为46,则该物质的分子式是C
2H
6O,故答案为:C
2H
6O;
(3)A可能为乙醇或二甲醚,结构简式为CH
3CH
2OH、CH
3-O-CH
3,故答案为:CH
3CH
2OH、CH
3-O-CH
3;
(4)有机物A分子中有三种不同化学环境的氢原子,应为乙醇,即CH
3CH
2OH,二甲醚只有一种不同化学环境的氢原子,故答案为:CH
3CH
2OH;
(5)A在一定条件下脱水可生成B,B为CH
2=CH
2,B可合成包装塑料C,C为聚乙烯,B转化为C的化学反应方程式为
nCH
2=CH
2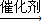
-[CH
2-CH
2 ]
n-,
故答案为:nCH
2=CH
2
-[CH
2-CH
2 ]
n-;
(6)原子利用率为100%,可用加成方法制备,反应的方程式为nCH
2=CH
2 +HCl

CH
3CH
2 Cl,
故答案为:nCH
2=CH
2 +HCl

CH
3CH
2 Cl;
(7)发生一系列的化学变化而变得更醇香,应为乙醇被氧化为乙酸,进而发生酯化反应生成乙酸乙酯,反应的方程式为
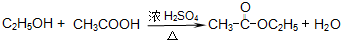
,
故答案为:
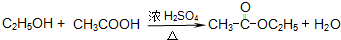
.
点评:本题考查有机物的推断,题目难度不大,本题注意根据生成5.4gH
2O和8.8gCO
2,消耗氧气6.72L,从质量守恒的角度判断有机物最简式,为解答该题的关键,注意把握题给信息.

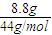 =0.2mol,n(H2O)=
=0.2mol,n(H2O)=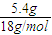 =0.3mol,n(O2)=
=0.3mol,n(O2)=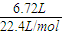 =0.3mol,结合质量守恒定律推断;
=0.3mol,结合质量守恒定律推断;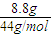 =0.2mol,n(H2O)=
=0.2mol,n(H2O)=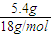 =0.3mol,n(O2)=
=0.3mol,n(O2)=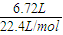 =0.3mol,则有机物中含n(O)=0.2mol×2+0.3mol-0.6mol=0.1mol,则有机物中N(C):N(H):N(O)=0.2mol:0.6mol:0.1mol=2:6:1,
=0.3mol,则有机物中含n(O)=0.2mol×2+0.3mol-0.6mol=0.1mol,则有机物中N(C):N(H):N(O)=0.2mol:0.6mol:0.1mol=2:6:1, -[CH2-CH2 ]n-,
-[CH2-CH2 ]n-, -[CH2-CH2 ]n-;
-[CH2-CH2 ]n-; CH3CH2 Cl,
CH3CH2 Cl, CH3CH2 Cl;
CH3CH2 Cl;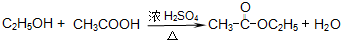 ,
,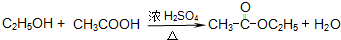 .
.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案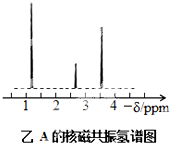 为测定某有机化合物A的结构,进行如下实验.
为测定某有机化合物A的结构,进行如下实验.

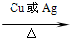 2CH3CHO+2H2O
2CH3CHO+2H2O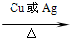 2CH3CHO+2H2O
2CH3CHO+2H2O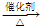
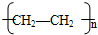 ,
,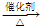
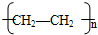 ,
,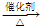 CH3CH2Cl,
CH3CH2Cl,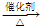 CH3CH2Cl,
CH3CH2Cl, CH3COOC2H5+H2O,
CH3COOC2H5+H2O, CH3COOC2H5+H2O,
CH3COOC2H5+H2O,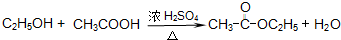
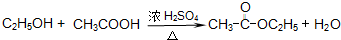
 为测定某有机化合物A的结构,进行如下实验.
为测定某有机化合物A的结构,进行如下实验.