
 人工肾脏可用间接电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如图.下列有关说法正确的是( )
人工肾脏可用间接电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如图.下列有关说法正确的是( )| A. | A为电源的负极 | |
| B. | 电解结束后,阴极室溶液的pH与电解前相比将不变 | |
| C. | 阳极室中发生的电极反应为2H++2e-═H2↑ | |
| D. | 若两极共收集到气体13.44 L(标准状况),则除去的尿素为18g(忽略气体的溶解) |
分析 A、根据电解池中阴离子在阳极放电和阳离子在阴极放电的规律,结合本题图中的电极产物氯气、CO2和N2可以判断出A为电源的正极,B为电源的负极;
B、阴极反应为:6H2O+6e-═6OH-+3H2↑(或6H++6e-═3H2↑)阳极反应为:6Cl--6e-═3Cl2↑,CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl,根据上述反应式可以看出在阴、阳极上产生的OH-、H+的数目相等,阳极室中反应产生的H+通过质子交换膜进入阴极室与OH-恰好反应生成水,所以阴极室中电解前后溶液的pH不变;
C、由图可知,阳极室首先是氯离子放电生成氯气,氯气再氧化尿素生成氮气、二氧化碳,同时会生成HCl;
D、根据n=$\frac{V}{22.4}$计算两极产生的气体的物质的量,利用气体中各组分的比例关系,计算n(N2)=n(CO2),再根据方程式计算尿素的物质的量,根据m=nM计算尿素的质量.
解答 解:A、由图可知,左室电极产物为氯气、CO2和N2,发生氧化反应,故A为电源的正极,右室电解产物H2,发生还原反应,故B为电源的负极,故A错误;
B、阴极反应为6H2O+6e-═6OH-+3H2↑(或6H++6e-═3H2↑),阳极反应为6Cl--6e-═3Cl2↑,CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl,根据上述反应式可以看出在阴、阳极上产生的OH-、H+的数目相等,阳极室中反应产生的H+通过质子交换膜进入阴极室与OH-恰好反应生成水,所以阴极室中电解前后溶液的pH不变,故B正确;
C、由图可知,阳极室首先是氯离子放电生成氯气,氯气再氧化尿素生成氮气、二氧化碳,同时会生成HCl,阳极室中发生的反应依次为:2Cl--2e-═Cl2↑,CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl,故C错误;
D、电解收集到的13.44L气体,物质的量为$\frac{13.44L}{22.4L/mol}$=0.6mol,由反应CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl可知n(N2)=n(CO2)=0.6mol×$\frac{1}{5}$=0.12 mol,可知生成0.12mol N2所消耗的CO(NH2)2的物质的量也为0.12mol,其质量为:m[CO(NH2)2]=0.12 mol×60 g•mol-1=7.2g,故D错误;
故选:B.
点评 本题考查电解池原理与有关计算,难度较大,B中关键注意观察电极产物,判断发生的反应,注意根据方程式判断左室中pH值的变化.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:解答题
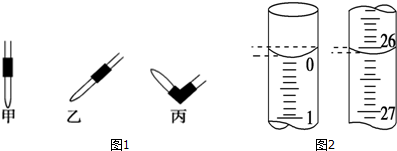
| 实验编号 | NaOH溶液的浓度(mol•L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸的体积(mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 步骤1为吸热反应,步骤2为放热反应 | |
| B. | E2>E3>E1 | |
| C. | 1mol C发生该反应时吸收的能量为E3-E1 | |
| D. | E2-E1<E2-E3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3溶于过量的浓KOH溶液中:NH4++HCO3-+2OH-═CO32-+NH3↑+2H2O | |
| B. | 碳酸钠溶液中加入澄清石灰水:Ca(OH)2+CO32-═CaCO3↓+2OH- | |
| C. | 稀硫酸中加入铁粉:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 醋酸除去水垢:2H++CaCO3═Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:9 | B. | 10:9 | C. | 9:2 | D. | 9:10 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
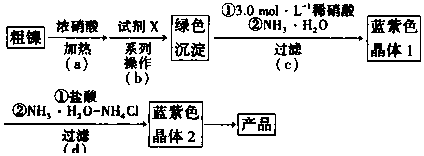
| Fe3+ | Cr3+ | Ni2+ | |
| 开始沉淀pH | 1.5 | 4.3 | 6.9 |
| 完全沉淀pH | 2.8 | 5.6 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
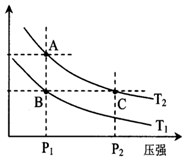 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 难溶电解质在水中存在沉淀溶解平衡,且是一种动态平衡 | |
| B. | Ksp只与难溶电解质的性质和温度有关,而与沉淀的量和离子浓度无关 | |
| C. | 在一定温度下的BaSO4饱和溶液中加入少量BaCl2固体,BaSO4的Ksp减少 | |
| D. | 当阴、阳离子个数比相同时,难溶电解质的Ksp数值越大,溶解能力越强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com