
【题目】在下列反应中,水既不是氧化剂又不是还原剂的是
A. C+H2O![]() CO+H2
CO+H2
B. ![]()
C. ![]()
D. ![]()
【答案】B
【解析】
在氧化还原反应中,若水既不是氧化剂又不是还原剂,则水中H、O元素的化合价在反应前后不发生变化,据此判断。
A、C+H2O![]() CO+H2的反应中,H元素的化合价降低,水是氧化剂,碳元素化合价升高,碳是还原剂,故A不选。
CO+H2的反应中,H元素的化合价降低,水是氧化剂,碳元素化合价升高,碳是还原剂,故A不选。
B、过氧化钠与水的反应中,过氧化钠中O元素的化合价既升高又降低,过氧化钠既是氧化剂又是还原剂,水中元素的化合价均不变,不是氧化剂也不是还原剂,故B选;
C、Na与水的反应中,Na元素的化合价升高,水中H元素的化合价降低,则水作氧化剂,钠是还原剂,故C不选;
D、单质氟与水的反应中,F元素的化合价降低,水中O元素的化合价升高,则水作还原剂,单质氟作氧化剂,故D不选;
故答案选B。


科目:高中化学 来源: 题型:
【题目】A~E是中学常见的5种化合物,A、B是氧化物,它们之间的转化关系如下图所示。则下列说法正确的是( )

A. X与A反应的化学方程式是:Al2O3 + 2Fe ![]() Fe2O3 + 2Al
Fe2O3 + 2Al
B. 检验D溶液中的金属阳离子的反应:Fe3++3SCN—= Fe(SCN)3↓
C. 单质Y在一定条件下能与水发生置换反应
D. 由于化合物B和C均既能与酸反应,又能与碱反应,所以均是两性化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋经济已经成为拉动我国国民经济发展的重要引擎,海水的综合开发、利用是海洋经济的一部分,海水中可提取多种化工原料,下面是工业上对海水的几项综合利用的示意图。其流程如下图所示:

(1)写出镁原子的结构示意图:_________________。在反应①→⑤中属于氧化还原反应的是___________(填序号);
(2)粗盐中含有Na2SO4、MgCl2、CaCl2等可溶性杂质,为制得纯净的NaCl晶体,操作如下:①溶解;②依次加入过量的BaCl2溶液、NaOH溶液、________溶液;③_________;④滤液中加适量盐酸;⑤__________(请补全缺少的实验步骤或试剂);
(3)某同学利用反应①原理制备氯气,将200 mL 5.0 mol·L-1NaCl溶液进行电解,则理论上最多可制得标准状况下氯气的体积为__________L;
(4)实验室模拟Mg的制取流程时,用11.3 mol·L-1的浓盐酸配置反应③所需要的0.5 mol·L―1稀盐酸100 mL,需要用量筒量取浓盐酸________mL,接下来的配制过程除了玻璃棒和烧杯外,还需要用到的玻璃仪器有___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子反应方程式正确的是
A. 氯气溶于水:![]()
B. 碳酸氢钠和氢氧化钠溶液反应:HCO3-+OH-=CO32-+H2O
C. ![]() 溶液中加入
溶液中加入![]() 溶液:
溶液:![]()
D. 铁和稀硝酸反应:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以葡萄糖为原料制得的山梨醇(A)和异山梨醇(B)都是重要的生物质转化平台化合物。E是一种治疗心绞痛的药物,由葡萄糖为原料合成E的过程如下:
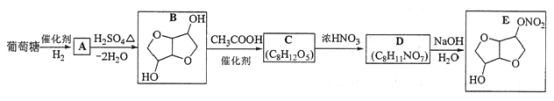
回答下列问题:
(1)葡萄糖的分子式为__________。
(2)A中含有的官能团的名称为__________。
(3)由B到C的反应类型为__________。
(4)C的结构简式为__________。
(5)由D到E的反应方程式为______________。
(6)F是B的同分异构体,7.30 g的F与足量饱和碳酸氢钠反应可释放出2.24 L二氧化碳(标准状况),F的可能结构共有________种(不考虑立体异构),其中核磁共振氢谱为三组峰,峰面积比为3∶1∶1的结构简式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断下列概念的依据正确的是
A.纯净物与混合物:是否仅含有一种元素
B.溶液与胶体的本质区别:能否发生丁达尔现象
C.酸的本质:电离时产生的阳离子是否全是H+
D.电解质与非电解质:在溶液中或熔融状态下能否导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2是纺织工业中常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”。S2O32-和Cl2反应的产物之一为SO42-。下列说法中,不正确的是( )
A. 该反应中氧化剂是Cl2
B. 根据该反应可判断还原性:S2O32->Cl-
C. 上述反应中,每生成lmolSO42-,可脱去2molCl2
D. SO2与氯气的漂白原理相同,所以也可以用SO2做纺织工业的漂白剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应进行的方向和限度是化学反应原理所要研究的两个重要问题,下列有关化学反应进行的方向和限度的说法中正确的是( )
A. mA(g)+nB(g)![]() pC(g),平衡时A的浓度等于0.5mol/L,将容器体积扩大一倍,达到新的平衡后A的浓度变为0.3mol/L,则计量数m+n < p
pC(g),平衡时A的浓度等于0.5mol/L,将容器体积扩大一倍,达到新的平衡后A的浓度变为0.3mol/L,则计量数m+n < p
B. 对于反应A(g)+B(g)![]() 2C(g),起始充入等物质的量的A和B,达到平衡时A的体积分数为n%,此时若给体系加压则A的体积分数不变
2C(g),起始充入等物质的量的A和B,达到平衡时A的体积分数为n%,此时若给体系加压则A的体积分数不变
C. 将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中,在恒定温度下使其达到分解平衡:NH2COONH4(s) ![]() 2NH3(g)+CO2(g),则CO2的体积分数不变能作为平衡判断的依据
2NH3(g)+CO2(g),则CO2的体积分数不变能作为平衡判断的依据
D. 2NO(g)+2CO(g)===N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用LiOH和钴氧化物可制备锂离子电池正极材料。LiOH可由电解法制备,钴氧化物可通过处理钴渣获得。利用如图所示装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。下列说法正确的是( )
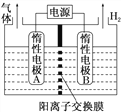
A. B极区电解液为LiCl溶液
B. 阳极电极反应式为2Cl--2e-===Cl2↑
C. 电解过程中Li+向A电极迁移
D. A极区产生0.1mol气体,则溶液中有0.4molLi+移向B电极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com