
����Ŀ������������Ԫ��X��Y��Z��W��ԭ������������������ͼ��ʾ������ת����ϵ�У�p��q�� m��n�ֱ���Ԫ��W��X��Y��Z�����嵥�ʣ�p�� s��Ϊ��ɫ���壬v��ˮ��Һ�ʼ��ԡ������£�0.1 mol L ��1t ��Һ�� 0.1 mol L ��1 u ��Һ��pH��Ϊ1������˵������ȷ����

A.Y��W������������Ӧ��ˮ�����Ϊǿ��
B.Z��Y�ļ��⻯����ȶ��Ժͷе�ߵ;�Ϊ��Z��Y
C.s����ˮ�ķ�Ӧ�У��������뻹ԭ�������ʵ���֮��Ϊ1:2
D.v�ĵ���ʽ�ɱ�ʾΪ![]()
���𰸡�D
��������
����������Ԫ��X��Y��Z��W��ԭ��������������p��q��m��n�ֱ���Ԫ��W��X��Y��Z�����嵥�ʡ�p��q��Ӧ����u��uΪ��Ԫ�������������0.1mol��L-1u��Һ��pHΪ1����uΪHCl����ԭ��������֪��XΪHԪ�ء�WΪClԪ�أ���qΪH2��pΪCl2��q��m��Ӧ����v��v��ˮ��Һ�ʼ��ԣ���mΪN2��vΪNH3����YΪNԪ�أ�m��n�ڷŵ������µõ�r��r��n�õ���ɫ����s����s��ˮ��Ӧ�õ�r��t����������0.1mol��L-1t��Һ��pHΪ1��tΪһԪǿ�ᣬ��nΪO2��rΪNO��sΪNO2��tΪHNO3����ZΪOԪ��, ���Ͽ�֪XΪHԪ�ء�YΪNԪ�ء�ZΪOԪ�ء�WΪClԪ�ء�
A��Y��W������������Ӧ��ˮ�����ΪHNO3��HClO4�����߾�Ϊǿ�ᣬ��ѡ��A��ȷ��
B��Z��Y�ļ��⻯��ֱ�ΪH2O��NH3��ˮ���ȶ��Ժͷе�����ڰ�������ѡ��B��ȷ��
C��sΪNO2��3NO2+ H2O= 2HNO3+ NO���������뻹ԭ�������ʵ���֮��Ϊ1:2����ѡ��C��ȷ��
D��vΪNH3�������ʽ�ɱ�ʾΪ ![]() ����ѡ��D����
����ѡ��D����
��ѡD��


 ��ĩ���ƾ�ϵ�д�
��ĩ���ƾ�ϵ�д� ���ɿ��ñ���ϵ�д�
���ɿ��ñ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���ļ���ʽ��ͼ��ʾ�����й��ڸ��л������������ȷ����
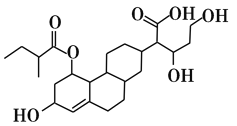
A.����4�ֹ�����
B.�ܷ���ȡ�����ӳɡ���������������ԭ�ȷ�Ӧ
C.1mol������������3molH2�����ӳɷ�Ӧ
D.���л�����Na��NaOH��Na2CO3���ܷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����0.1 mol/L��NaOH��Һ����ʢ��50 mLpH=2 ��HA��Һ�ľ��������У�����NaOH��Һ�����V����Һ�¶�T�Ĺ�ϵ��ͼ������˵����ȷ����( )

A.a����Һ�У�c(A-)+c(HA)=0.08 mol/L
B.b����Һ�У�c(A-)<c(Na+)
C.a��b�Ĺ����У����������ȷ�Ӧ
D.��Һ��HA�ĵ���ƽ�ⳣ��a�����b��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() ���о�ˮ���ã�����ʴ�豸�����ۺ��Ȼ�����һ�����͵���������������ˮ��
���о�ˮ���ã�����ʴ�豸�����ۺ��Ȼ�����һ�����͵���������������ˮ��![]() ��Ч���Ҹ�ʴ��С����ش��������⣺
��Ч���Ҹ�ʴ��С����ش��������⣺
(1)![]() ��ˮ��ԭ����________________________________________��
��ˮ��ԭ����________________________________________��![]() ��Һ��ʴ�����豸����
��Һ��ʴ�����豸����![]() �����⣬��һ��Ҫԭ����(�����ӷ���ʽ��ʾ)__________________________________��
�����⣬��һ��Ҫԭ����(�����ӷ���ʽ��ʾ)__________________________________��
(2)![]() ����Һ�з�����ˮ�⣺
����Һ�з�����ˮ�⣺
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
����ˮ�ⷴӦ��ƽ�ⳣ��![]() �ɴ�С��˳����___________________________________________________________��
�ɴ�С��˳����___________________________________________________________��
(3)ͨ����������������ˮ�����ۺϣ����ɾۺ��Ȼ��������ӷ���ʽΪ��![]()
![]()
![]()
��ʹƽ�������ƶ��ɲ��õķ�����(�����)________��
a.���� b.��ˮϡ��
c.����![]() d.����
d.����![]()
�����£�ʹ�Ȼ�����Һת��Ϊ��Ũ�Ⱦۺ��Ȼ����Ĺؼ�������____________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ���Ӧ�������������![]()
A. ��ͼ��ʾͬ�¶��£�
��ͼ��ʾͬ�¶��£�![]() ������ʹ�����Һ�ֱ��ˮϡ��ʱpH�ı仯���ߣ��������ߢ�Ϊ���ᣬ��b����Һ�ĵ����Ա�a��ǿ
������ʹ�����Һ�ֱ��ˮϡ��ʱpH�ı仯���ߣ��������ߢ�Ϊ���ᣬ��b����Һ�ĵ����Ա�a��ǿ
B. ��ͼ��ʾ
��ͼ��ʾ![]()
![]() ��Һ�ζ�
��Һ�ζ�![]()
![]()
![]() ��Һ���õ��ĵζ�����
��Һ���õ��ĵζ�����
C. ��ͼ��ʾѹǿ�Կ��淴Ӧ
��ͼ��ʾѹǿ�Կ��淴Ӧ![]() ��Ӱ�죬�ҵ�ѹǿ�ȼ�ѹǿ��
��Ӱ�죬�ҵ�ѹǿ�ȼ�ѹǿ��
D. ��ͼ����ȥ
��ͼ����ȥ![]() ��Һ�е�
��Һ�е�![]() ������Һ�м�������CuO��pH��4����
������Һ�м�������CuO��pH��4����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮϵ�����ӵ�ذ�ȫ���ܺá��۸�������Ի����Ѻã����ž���г�ǰ����ij�����ӵ�ع���ԭ����ͼ������ܷ�ӦΪ��2NaFePO4F + Na3Ti2(PO4)3![]() 2Na2FePO4F+ NaTi2(PO4)3
2Na2FePO4F+ NaTi2(PO4)3
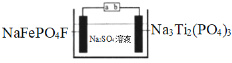
����˵���������
A.���ʱ��a�ӵ�Դ����
B.�ŵ�ʱ����Һ�е�Na+��NaFePO4F�缫�ϵõ��ӱ���ԭ
C.���ʱ�������ϵĵ缫��ӦΪNaTi2(PO4)3+2Na++2e��=Na3Ti2(PO4)3
D.�����ϣ��õ���ڳ���ŵ��������Һ�е�c(Na+)����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£�������Ӧ����M(s)+N(g) ![]() R(g) ��H=��Q1 kJ/mol����2R(g)+N(g)
R(g) ��H=��Q1 kJ/mol����2R(g)+N(g) ![]() 2T(g) ��H=��Q2 kJ/mol��Q1��Q2��Q3��Ϊ��ֵ������˵����ȷ���� ���� ����
2T(g) ��H=��Q2 kJ/mol��Q1��Q2��Q3��Ϊ��ֵ������˵����ȷ���� ���� ����
A.1mol R(g)�������ܺʹ���1mol M(s)��1mol N(g)�������ܺ�
B.��2mol R(g)��1mol N(g)�ڸ������·�Ӧ�����Էų�����Q2 kJ
C.��1mol M(s)��ȫת��ΪT(g)ʱ���ٶ���������ʧ�����ų�����![]()
D.M(g)+N(g) ![]() R(g) ��H=��Q3 kJ/mol����Q3 ��Q1
R(g) ��H=��Q3 kJ/mol����Q3 ��Q1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ�ζ�ͬ�к͵ζ�����(����֪Ũ�ȵ���������Һ�ζ�δ֪Ũ�ȵĻ�ԭ����Һ��֮)������0.0010 mol��L1����KMnO4��Һ�ζ�δ֪Ũ�ȵ���ɫNaHSO3��Һ����Ӧ�����ӷ���ʽΪ2![]() ��5
��5![]() ��H��=2Mn2+��5
��H��=2Mn2+��5![]() ��3H2O��������������⣺
��3H2O��������������⣺
(1)��ʵ����˵ζ���(50 mL)������̨���ζ��ܼС��ձ� ����ֽ����������Ʒ�⣬������ʹ�õ�������____________��
(2)ʵ������_____(����������������)ʽ�ζ���ʢװ����KMnO4��Һ��ԭ����_______��
(3)��ʵ��_______(������Ҫ����������Ҫ��)ʹ��ָʾ�����ζ��յ��������__________��
(4)�ٵζ�ǰƽ��Һ�棬�̶�Ϊa mL���ζ����ӿ̶�Ϊb mL������(ba) mL����õ��Ĵ���ҺŨ�ȱ�ʵ��Ũ��_____(����������������)��
�����ζ�ʱ���õ�����KMnO4��Һ����ö�����Ũ�ȱ�С�����ɴ˲�õĴ���ҺŨ��ֵ��____(����ƫС����ƫ��������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2SO3�Ƕ�Ԫ���ᣬNaHSO3��Һ�����ԣ���0.1 mol��L-1 NaHSO3��Һ�У����й�ϵ��ȷ����
A.![]()
B.![]()
C.![]()
D.![]()
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com