
【题目】下列说法正确的是( )
A.可加热NH4NO3晶体制备氨气
B.可以用湿润的红色石蕊试纸检验氨气
C.将蘸有浓氨水和浓硫酸的玻璃棒靠近,观察到白烟
D.除去碘中混有的少量氯化铵,可采用升华的方法
科目:高中化学 来源: 题型:
【题目】氮化镓(GaN)被称为第三代半导体材料,其应用已经取得了突破性的进展。
已知:(i)氮化镓性质稳定,不与水、酸反应,只在加热时溶于浓碱。
(ii)NiCl2 溶液在加热时,先转化为Ni(OH)2,后分解为NiO。
(iii)制备氮化镓的反应为:2Ga+2NH3![]() 2GaN+3H2
2GaN+3H2
某学校化学兴趣小组实验室制备氮化镓,设计实验装置如图所示:

设计实验步骤如下:
①滴加几滴NiCl2 溶液润湿金属镓粉末,置于反应器内。
②先通入一段时间后的H2,再加热。
③停止通氢气,改通入氨气,继续加热一段时间。
④停止加热,继续通入氨气,直至冷却。
⑤将反应器内的固体转移到盛有盐酸的烧杯中,充分反应过滤、洗涤、干燥。
(1)仪器X中的试剂是___________,仪器Y的名称是__________________。
(2)指出该套装置中存在一处明显的错误是________________________。
(3)步骤①中选择NiCl2 溶液,不选择氧化镍的原因是____________________。
a.增大接触面积,加快化学反应速率
b使镍能均匀附着在镓粉的表面,提高催化效率
c.为了能更好形成原电池,加快反应速率
(4)步骤③中制备氮化镓,则判断该反应接近完成时观察到的现象是____________________。
(5)请写出步骤⑤中检验产品氮化镓固体洗涤干净的操作________________________。
(6)镓元素与铝同族,其性质与铝类似,请写出氮化镓溶于热NaOH溶液的离子方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下表是元素周期表的一部分,其中每个数字序号代表一种短周期元素。根据表中所列①~⑨元素,请按要求回答下列问题:
⑩ | ||||||||
① | ② | ③ | ||||||
④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(1)元素①形成的最高价氧化物的电子式为__________ ,⑤⑨两种元素形成的化合物的电子式为__________,①~⑨元素的最高价氧化物的水化物酸性最强的是__________ (填化学式)。
(2)①、⑦两种元素的最高价氧化物的熔点较高的是___________(填化学式)。
(3)由②③⑩三种元素组成的离子化合物中所含有的化学键有____________ 。
(4)①的单质与②的最高价氧化物的水化物的浓溶液反应的化学方程式为____________________。
(5)下列事实能说明③非金属性比⑧强的有___________。
a.③的单质与⑧的氢化物溶液反应,溶液变浑浊
b.③⑧形成简单离子时,得电子数目的多少
c.③与⑧两元素的简单氢化物受热分解,前者的分解温度高
d.③原子半径比⑧小
e.③与⑧两元素的简单氢化物的沸点,前者高
Ⅱ. 短周期元素W、X、Y、Z的原子序数依次增大。m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r为液体,其余均为无色气体, m 的摩尔质量为p的2倍,n是元素Y的单质, p物质能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色。上述的转化关系如图所示。下列说法正确的是__________ 。

A.原子半径:Y< X< Z
B.非金属性:Y> X> W
C.q与s均为酸性氧化物
D.常温下,m与q,n与s均不能共存
E.若n过量,q还可以继续燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组以CoCl26H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体Cox(NH3)y ClZ . 为测定其组成,进行如下实验. Ⅰ.氨的测定:精确称取wg样品,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1mLc1molL﹣1的盐酸标准溶液吸收.蒸氨结束后取下接收瓶,用c2molL﹣1 NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液.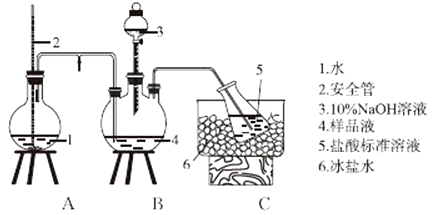
氨的测定装置(已省略加热和加持装置)
Ⅱ.氯的测定:另准确称取wg样品,配成溶液后用AgNO3标准溶液滴定.已知:AgCl为白色沉淀Ksp(AgCl)=1.8×10﹣10;Ag2CrO4为砖红色沉淀,Ksp(Ag2CrO4)=1.2×10﹣12;Ag2S为黑色沉淀,Ksp(Ag2S)=6.3×10﹣50 .
Ⅲ.根据样品质量为wg即可确定样品中Co元素的质量,进而确定样品的化学组成.
回答下列问题:
(1)实验前,按图组装好装置后,如何检查该装置的气密性;
(2)盛装10%NaOH溶液的仪器名称;
(3)样品中氨的质量分数表达式为;
(4)标准硝酸银溶液应装在棕色的式滴定管中;若滴定管未用标准液润洗,则测定Cl﹣的量 .(填“偏大”“偏小”)
(5)在测定氯的过程中,应选用(填“K2CO3”或“K2S”)为指示剂,判断达到测定终点时的操作和现象为 .
(6)当达到滴定终点时,若c(Ag+)=1.0×10﹣5 molL﹣1 , ![]() =,(或
=,(或 ![]() =)(根据所选指示剂进行填空)
=)(根据所选指示剂进行填空)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成新型高分子M的路线如图: 
为了测定上述转化流程中有机物H的结构,做如下实验:
①将2.3g有机物H完全燃烧,生成0.1molCO2和2.7g水
②H的质谱图和核磁共振氢谱图分别为图1和图2: 
试回答下列问题:
(1)有机物H中官能团的名称 .
(2)A的分子式是C7H8 , 反应①的化学方程式: .
(3)E的分子式是C6H10O2 , E的结构简式为 .
(4)试剂b是 , 反应④的反应类型是 .
(5)反应⑥的化学方程式: .
(6)已知: 以H为起始原料,选用必要的无机试剂合成E,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某主族元素R的最高正化合价与最低负化合价的代数和为4,下列有关叙述正确的是
A.R一定是第4周期元素
B.R的气态氢化物化学式为H2R
C.R的气态氢化物比同周期其他元素的气态氢化物稳定
D.R的气态氢化物的水溶液显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十九大报告指出,“建设生态文明是中华民族水续发展的千年大计”。控制和治理NOx、SO2、CO2是解决光化学烟算、减少酸雨和温室效应的有效途径,对构建生态文明有着极为重要的意义。回答下列问题:
(1)利用SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。
①SCR(选择催化还原NOx)工作原理:
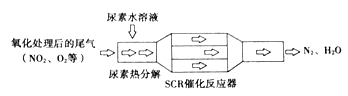
尿素水溶液热分解为NH3和CO2的化学方程式为________,SCR催化反应器中NH3还原NO2的化学方程式为__________。
②NSR(NOx储存还原)工作原理:
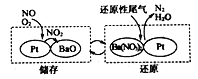
在储存过程中,NO发生的总化学反应方程式为__________
(2)双碱法除去SO2的工作原理:NaOH溶液![]() Na2SO3溶液
Na2SO3溶液
过程①的离子方程式为_____;CaO在水中存在如下转化:CaO(s)+H2O(1)=Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq),从平衡移动的角度,简述过程②NaOH再生的原理____________.
Ca2+(aq)+2OH-(aq),从平衡移动的角度,简述过程②NaOH再生的原理____________.
(3)人工光合作用技术回收利用二氧化碳的工作原理:
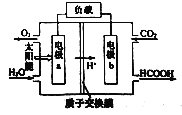
a极为_______极,b极的电极反应式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com