
| A. | 石油的分馏和煤的干馏都属于物理变化 | |
| B. | 通过对95%的酒精直接蒸馏获得无水酒精 | |
| C. | 在石油的分馏、实验室制乙烯以及制备硝基苯的三个实验中,温度计水银球的位置分别位于蒸馏烧瓶支管口、反应液液面以下、水浴中 | |
| D. | 用C8H18萃取溴水中的溴,可观察到溶液分层,下层为橙红色,上层接近无色 |
分析 A.煤的干馏属于化学变化;
B.酒精与水易形成共沸混合物;
C.石油的分馏、实验室制乙烯以及制备硝基苯的三个实验中,温度计分别用于测定馏分、反应液以及水的温度;
D.己烷的密度比水小,在溶液上层.
解答 解:A.煤的干馏属于复杂的物理、化学变化,故A错误;
B.酒精与水易形成共沸混合物,应加CaO后蒸馏,故B错误;
C.石油的分馏、实验室制乙烯以及制备硝基苯的三个实验中,温度计分别用于测定馏分、反应液以及水的温度,则温度计水银球的位置分别位于蒸馏烧瓶支管口、反应液液面以下、水浴中,故C正确;
D.己烷的密度比水小,在溶液上层,可观察到上层为橙红色,故D错误.
故选C.
点评 本题考查化学实验方案的评价,涉及化学实验基本操作方面的知识,涉及了除杂、加入试剂顺序、气体的检验方法等知识,侧重实验基本操作和实验原理的考查,本题难度中等.


科目:高中化学 来源: 题型:解答题
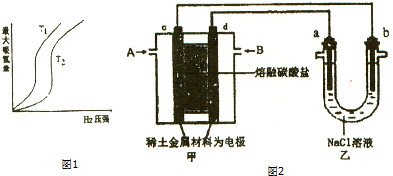
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
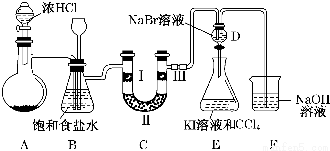
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯和水,酒精和水,植物油和水 | |
| B. | 四氯化碳和水,溴苯和水,硝基苯和水 | |
| C. | 甘油和水,乙酸和水,乙酸和乙醇 | |
| D. | 汽油和水,苯和甲苯,己烷和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
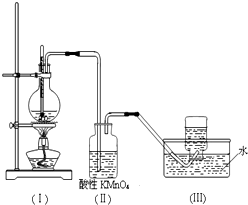 如图所示,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯,加热一段时间后观察到烧瓶中溶液变黑,装置(Ⅱ)中经硫酸酸化的高锰酸钾溶液褪色.
如图所示,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯,加热一段时间后观察到烧瓶中溶液变黑,装置(Ⅱ)中经硫酸酸化的高锰酸钾溶液褪色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
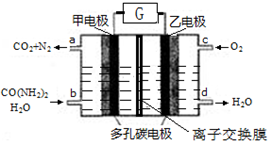
| A. | 甲电极是阴极 | B. | 电解质溶液可以是KOH溶液 | ||
| C. | H+从甲电极附近向乙电极附近迁移 | D. | 每2molO2理论上可净化1molCO(NH2)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
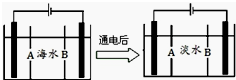 科研人员对某岛上山泉水进行分析化验,结果显示山泉水属于硬水.
科研人员对某岛上山泉水进行分析化验,结果显示山泉水属于硬水.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com