
| A. | 酸性:H2CO3>HNO3 | B. | 碱性:NaOH>KOH | ||
| C. | 非金属性:Si>P | D. | 气态氢化物稳定性:H2O>H2S |
分析 A.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
B.元素的金属性越强,其最高价氧化物的水化物碱性越强;
C.同一周期元素,元素的非金属性随着原子序数增大而增强;
D.元素的非金属性越强,其氢化物的稳定性越强.
解答 解:A.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性N>C,所以酸性:H2CO3<HNO3,故A错误;
B.元素的金属性越强,其最高价氧化物的水化物碱性越强,金属性K>Na,所以碱性NaOH<KOH,故B错误;
C.同一周期元素,元素的非金属性随着原子序数增大而增强,则非金属性P>Si,故C错误;
D.元素的非金属性越强,其氢化物的稳定性越强,非金属性O>S,则气态氢化物稳定性:H2O>H2S,故D正确;
故选D.
点评 本题考查元素周期律,为高频考点,明确同一周期、同一主族元素原子结构、元素性质递变规律是解本题关键,侧重考查学生分析判断能力,知道非金属性、金属性强弱与其最高价氧化物的水化物酸碱性关系,题目难度不大.


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 容器内压强不随时间变化 | |
| B. | 容器内各物质的浓度不随时间变化 | |
| C. | 容器内X、Y、Z浓度之比为1:2:2 | |
| D. | 混合气的平均摩尔质量不随时间变化时 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 仪器 |
| A | 除去氯化钠溶液中的泥沙 | 漏斗(带滤纸)、烧杯、玻璃棒 |
| B | 从食盐水中获得NaCl晶体 | 坩埚、玻璃棒、酒精灯、泥三角 |
| C | 用0.10mol•L-1的盐酸测定未知浓度的NaOH溶液浓度 | 碱式滴定管、酸式滴定管、锥形瓶、胶头滴管、烧杯 |
| D | 用MnO2和浓盐酸制取干燥、纯净的Cl2 | 圆底烧瓶、分液漏斗、酒精灯、洗气瓶、集气瓶、导管、石棉网 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸的装运包装箱应贴上如图所示标志  | |
| B. | 少量金属金属钠保存在CCl4中 | |
| C. | 镁带着火应用干粉灭火器灭火,不能用泡沫灭火器灭火 | |
| D. | 用25ml酸式滴定管量取20.00ml0.01 mol/L的Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
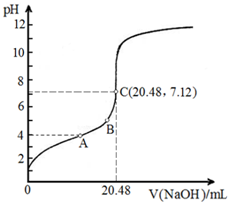 请完成并配平上列的离子方程式.
请完成并配平上列的离子方程式.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸锶难溶于水 | B. | 氢氧化锶的碱性比氢氧化钙弱 | ||
| C. | 单质锶跟冷水不反应 | D. | 锶是第四周期元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
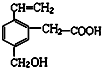
| A. | 可与NaOH溶液反应 | B. | 可发生酯化反应 | ||
| C. | 可使酸性KMnO4溶液褪色 | D. | 可在碱性条件下水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化镁溶液中加氨水:Mg2++2NH3•H2O=Mg(OH)2↓+2NH4+ | |
| B. | 钠与水反应:Na+2H2O=Na++2OH-+H2↑ | |
| C. | 稀硫酸与氢氧化钡溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| D. | 碳酸钙溶于醋酸溶液:CaCO3+2H+=Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
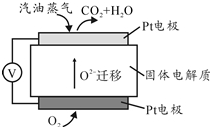 为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示:一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O${\;}_{2}^{-}$
为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示:一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O${\;}_{2}^{-}$查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com