
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:解答题
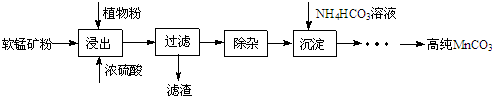
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(g) | B. | C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(1) | ||
| C. | C2H2(g)+$\frac{3}{2}$O2(g)=2CO2(g)+H2O(g) | D. | C2H2(g)+$\frac{3}{2}$O2(g)=2CO(g)+H2O(1) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 作为测量中和反应反应热的装置图,从玻璃仪器的角度看,图1还缺少环形玻璃搅拌棒 | |
| B. | 检验图2装置的气密性时,向漏斗中加水若出现图中所示的现象,可以证明该气密性良好 | |
| C. | 已知图3是利用原电池检验空气中Cl2含量的装置,其中Pt电极作负极 | |
| D. | 根据图4的溶解度变化可知,在较低温度下容易分离MgSO4•7H2O和CaSO4•2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com