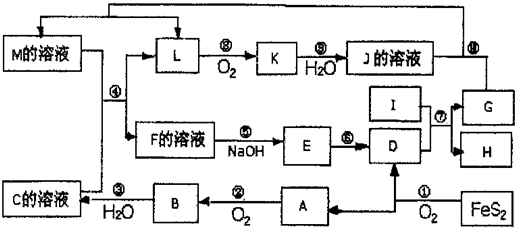
解:FeS
2氧化得到的A可以继续被氧化,则A为SO
2B为SO
3,C为B的水化物,C为H
2SO
4,D为Fe
2O
3,I为第三主族熔点最高的金属,应为Al,反应⑦为铝单质与金属氧化物所发生的置换反应,即铝热反应.K是一种红棕色气体,为NO
2,则J为HNO
3,L被氧化成为NO
2,故L可能为氨或NO
2,由于C溶液,即硫酸溶液能与某M溶液反应得到L,故L不可能是碱性的气体氨气,故L为NO,G能与硝酸反应并能产生NO,故G为Fe,H为Al
2O
3,M成分复杂,既有硝酸铁,又有硝酸亚铁,故在加入硫酸后,与原有的硝酸根离子形成了硝酸的条件,使得亚铁离子被氧化,硝酸根被还原.最后,由于D为Fe
2O
3,而有框图中可知E为氢氧化物,E经由一步转变为D,故E为Fe(OH)
3,而E直接由F加入碱而得到,故F为三价铁离子,其阴离子可能为硫酸根与硝酸根的混合物,或者是仅有硫酸根离子,由于题目所给物质名称仅为F,故可知F为纯净物硫酸铁,
(1)由以上分析可知I为Al,原子核外由3个电子层,最外层电子数为3,位于周期表第三周期、ⅢA族,
故答案为:三、ⅢA;
(2)反应⑦为Al与Fe
2O
3所发生的置换反应,方程式为2Al+Fe
2O
3
2Fe+Al
2O
3,氧化剂与还原剂的物质的量之比为
1:2,故答案为:1:2;
(3)在反应②、③、⑥、⑨中,②、⑥、⑨都为氧化还原反应,③为SO
3+H
2O=H
2SO
4的反应,既属于化合反应又属于非氧化还原反应,故答案为:③;
(4)M中含有Fe
2+和NO
3-,在酸性条件下可发生氧化还原反应,反应的离子方程式为Fe
2++4H
++NO
3-=3Fe
3++NO↑+2H
2O,
故答案为:Fe
2++4H
++NO
3-=3Fe
3++NO↑+2H
2O.
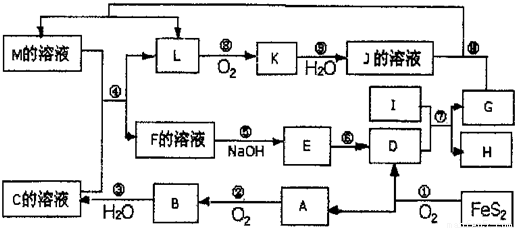
分析:FeS
2氧化得到的A可以继续被氧化,则A为SO
2B为SO
3,C为B的水化物,C为H
2SO
4,D为Fe
2O
3,I为第三主族熔点最高的金属,应为Al,反应⑦为铝单质与金属氧化物所发生的置换反应,即铝热反应.K是一种红棕色气体,为NO
2,则J为HNO
3,L被氧化成为NO
2,故L可能为氨或NO
2,由于C溶液,即硫酸溶液能与某M溶液反应得到L,故L不可能是碱性的气体氨气,故L为NO,G能与硝酸反应并能产生NO,故G为Fe,H为Al
2O
3,
M成分复杂,既有硝酸铁,又有硝酸亚铁,故在加入硫酸后,与原有的硝酸根离子形成了硝酸的条件,使得亚铁离子被氧化,硝酸根被还原.最后,由于D为Fe
2O
3,而有框图中可知E为氢氧化物,E经由一步转变为D,故E为Fe(OH)
3,而E直接由F加入碱而得到,故F为三价铁离子,其阴离子可能为硫酸根与硝酸根的混合物,或者是仅有硫酸根离子,由于题目所给物质名称仅为F,故可知F为纯净物硫酸铁,因为硝酸根已被亚铁离子还原,结合对应物质的性质和题目要求解答该题.
点评:本题考查无机物的推断,题目难度中等,本题注意根据FeS
2与氧气反应的性质结合物质的反应特点和物理特性为突破口进行解答.

 2Fe+Al2O3,氧化剂与还原剂的物质的量之比为
2Fe+Al2O3,氧化剂与还原剂的物质的量之比为