
分析 ①氯化铵溶液中铵根离子水解溶液显酸性;
②温度越高,越促进弱离子水解;
③酸式滴定管和碱式滴定管分别盛装酸、碱,不能混用.
解答 解:①常温下,0.1mol/LNH4Cl溶液中铵根离子水解溶液显酸性,NH4++H2O?NH3•H2O+H+,溶液的pH<7,
故答案为:<;
②温度越高,越促进弱离子水解,温度越高氯化铁的水解程度越大,其溶液的pH越小,所以pH25℃1mol•L-1FeCl3溶液>80℃1mol•L-1FeCl3溶液,
故答案为:>;
③用已知浓度的NaOH溶液滴定未知浓度的盐酸,标准溶液为氢氧化钠溶液盛装在碱式滴定管,
故答案为:碱式.
点评 本题考查了盐类水解原理、酸碱滴定实验仪器使用、溶液PH比较等知识点,掌握基础是解题关键,题目较简单.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 该反应是个放热反应 | |
| B. | 反应物的总能量高于生成物的总能量 | |
| C. | H2O2仅为氧化剂 | |
| D. | H2O2既是氧化剂又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制一定物质的量浓度的硫酸溶液时,定容时俯视会造成溶液浓度偏高 | |
| B. | 量取15.20mL AgNO3溶液可以用酸式滴定管 | |
| C. | 过滤完毕,洗涤沉淀时应该向漏斗中加水至没过沉淀,用玻璃棒搅拌充分洗剂,重复2~3次 | |
| D. | 蒸发浓缩CuSO4溶液时,要用玻璃棒搅拌防止溶液溅出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
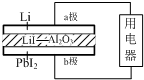 某锂碘电池以LiI-Al2O3固体为电解质传递离子,其基本结构示意图如下,电池总反应可表示为:2Li+PbI2=2LiI+Pb.下列说法正确的是( )
某锂碘电池以LiI-Al2O3固体为电解质传递离子,其基本结构示意图如下,电池总反应可表示为:2Li+PbI2=2LiI+Pb.下列说法正确的是( )| A. | 电子由b极经用电器流向a极 | |
| B. | I-由a极通过固体电解质传递到b极 | |
| C. | b极上的电极反应式为:PbI2-2e-=Pb+2I- | |
| D. | b极质量减少1.27 g 时,a极转移的电子数约为6.02×1021 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com