
| A. | ② | B. | ②⑤ | C. | ①③⑤ | D. | ③④⑤ |
分析 强弱电解质的根本区别是电离程度,部分电离的电解质是弱电解质,要证明醋酸是弱电解质,只要证明醋酸部分电离即可,可以根据醋酸钠溶液酸碱性、一定浓度的醋酸pH等方法判断,据此分析解答.
解答 解:A.①常温下某CH3COONa溶液的pH=8,说明醋酸钠是强碱弱酸盐,则醋酸为弱酸,故不选;
②用CH3COOH溶液做导电实验,灯泡很暗,说明醋酸溶液中离子浓度较小,不能说明醋酸部分电离,所以不能证明醋酸是弱电解质,故选;
③等pH等体积的盐酸、CH3COOH溶液和足量锌反应,CH3COOH放出的氢气较多,说明醋酸中存在电离平衡,则醋酸部分电离为弱电解质,故不选;
④0.1mol/L的CH3COOH溶液的pH=2.1,说明醋酸部分电离,为弱电解质,故不选;
⑤pH=1的CH3COOH溶液稀释100倍,pH<3,说明醋酸中存在电离平衡,为弱电解质,故不选;
故选A.
点评 本题考查强弱电解质判断,为高频考点,明确强弱电解质根本区别是解本题关键,注意不能根据电解质溶液导电性强弱、电解质溶解性强弱等方法判断,为易错题.


科目:高中化学 来源: 题型:解答题

 $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$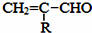
 的相对分子质量大2,则符合下列条件的G的同分异构体有3种.
的相对分子质量大2,则符合下列条件的G的同分异构体有3种. 的合成路线
的合成路线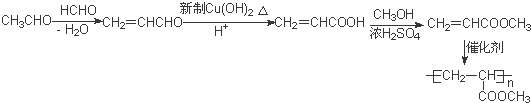 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液的pH小于盐酸 | |
| B. | 醋酸的电离方程式:CH3COOH=CH3COO-+H+ | |
| C. | c(CH3COOH)+c(CH3COO-)═c(Cl-) | |
| D. | 0.1mol•L-1 的醋酸溶液与等物质的量浓度、等体积的氢氧化钠溶液混合后:c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12 | B. | 11 | C. | 10 | D. | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 “诺龙”属于国际奥委会明确规定的违禁药品中合成代谢类的类固醇,其结构简式如图所示.下列关于“诺龙”的说法中错误的是( )
“诺龙”属于国际奥委会明确规定的违禁药品中合成代谢类的类固醇,其结构简式如图所示.下列关于“诺龙”的说法中错误的是( )| A. | 分子式是C18H26O2 | |
| B. | 能发生银镜反应 | |
| C. | 既能发生加成反应,也能发生酯化反应 | |
| D. | 既能发生氧化反应,也能发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com