
| 0.01mol•L-1 KIO3 酸性溶液(含淀粉)的体积/mL | 0.01mol•L-1 Na2SO3 溶液的体积/mL | H2O的体积 /mL | 实验 温度 /℃ | 溶液出现蓝色时所需时间/s | |
| 实验1 | 5 | V1 | 35 | 25 | |
| 实验2 | 5 | 5 | 40 | 25 | |
| 实验3 | 5 | 5 | V2 | 0 |
分析 依据表中数据判断实验目的,由实验2可以看出混合液的总体积为50mL,V1为10mL,V2为40mL,实验1和实验2可知实验目的是探究该反应速率与亚硫酸钠溶液浓度的关系;实验2和实验3可知实验目的是探究该反应速率与温度的关系.
解答 解:实验1和实验2探究该反应速率与亚硫酸钠溶液浓度的关系,实验2和实验3探究该反应速率与温度的关系;由实验2可以看出混合液的总体积为50mL,V1为10mL,V2为40mL,实验1和实验2可知实验目的是探究该反应速率与亚硫酸钠溶液浓度的关系;实验2和实验3可知实验目的是探究该反应速率与温度的关系,
故答案为:40;实验目的是探究温度、亚硫酸钠溶液浓度与该反应速率的关系.
点评 本题考查了探究该反应速率与溶液浓度、温度的关系,关键在于读表获取信息,注意对比实验中条件的统一,培养学生分析问题、解决问题能力.


科目:高中化学 来源: 题型:多选题
| A. | 上述反应中生成的N2是火箭燃料燃烧后的氧化产物 | |
| B. | 推动火箭飞行的强大动力源于该反应瞬间产生的大量高温气体 | |
| C. | 火箭发射时看到的红棕色气体是火箭起飞后,保险活动门自动开启,排出部分高压氧化剂在空气中氧化的结果 | |
| D. | 从能量变化上看,上述反应是热能转化为动能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
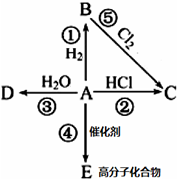 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A在一定条件下可发生如图所示的转化,请回答下列问题:
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A在一定条件下可发生如图所示的转化,请回答下列问题: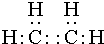 ,其中所含化学键的类型为共价键,E的结构简式为
,其中所含化学键的类型为共价键,E的结构简式为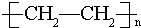 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
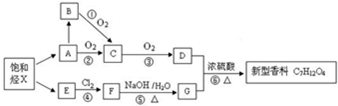
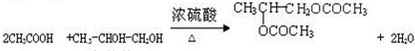 .
.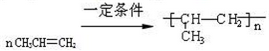 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 门捷列夫(俄国) | B. | 依马林(俄国) | ||
| C. | 别洛索夫(俄国) | D. | 马尔柯夫尼可夫(俄国) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中一定含有金属元素 | |
| B. | 分子晶体、原子晶体中一定含有共价键,离子晶体一定含有离子键 | |
| C. | 气态氢化物的稳定性:NH3>PH3>AsH3 | |
| D. | 正四面体结构的分子中的键角一定是109°28′ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 由现象1和现象3推测溶液甲中一定含有K2SiO3、NaNO2 | |
| B. | 由于在溶液甲中加入足量稀盐酸后再加入BaCl2溶液,因此无法判断溶液中是否有K2SO3 | |
| C. | 无法判断原混合物中是否含有KAlO2、K2CO3、MgCl2 | |
| D. | 根据现象5推测原混合物中一定含有Fe2O3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com