
| A. | ①③ | B. | ②④⑤ | C. | ①②⑤ | D. | ③⑥ |
分析 ①MnO4-在水溶液中显紫红色;
②使红色石蕊试纸变深蓝的溶液呈碱性,离子之间不反应且和氢氧根离子不反应的能大量共存;
③水电离的c(H+)=1×10-12mol/L的溶液,水的电离受到抑制,溶液为酸或碱溶液;
④该溶液为强碱溶液,溶液中存在大量的OH-离子,利用离子之间不能结合生成水、气体、沉淀等来分析离子的共存;
⑤使甲基橙变红的溶液,显酸性;
⑥pH=0的溶液为酸性溶液,硝酸根离子在酸性条件下能够氧化亚铁离子、硫离子、碘离子能够被氧化.
解答 解:①MnO4-在水溶液中显紫红色,与无色溶液不符,故①错误;
②使红色石蕊试纸变深蓝的溶液呈碱性,这几种离子之间不反应且和氢氧根离子不反应,所以能大量共存,故②正确;
③水电离的c(H+)=1×10-12mol/L的溶液,水的电离受到抑制,溶液为酸或碱溶液,HCO3-既能与酸反应又能与碱反应,则一定不共存,故③错误;
④因强碱溶液既能溶解Al(OH)3,又能溶解H2SiO3,则该溶液为强碱溶液,溶液中存在大量的OH-离子,Na+、SO42-、Cl-、ClO-在碱性溶液中该组离子之间不反应,则离子能大量共存,故④正确;
⑤使甲基橙变红的溶液,显酸性,MnO4-、NO3-、SO42-、Na+、Fe3+之间不反应,能共存,故⑤正确;
⑥pH=0的溶液中存在大量氢离子,硝酸根离子在酸性条件下具有强氧化性,Fe2+、I-、S2-能够被氧化-,在溶液中不能大量共存,故⑥错误;
故选B.
点评 本题考查离子的共存,侧重考查复分解反应、氧化还原反应,明确题目中的隐含信息及离子之间的反应是解答本题的关键,③为解答的易错点,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | H+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | a | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L CCl4的分子数约为NA个 | |
| B. | 常温常压下,3.2gO2和O3混合气体中含有的氧原子数目为0.2NA | |
| C. | 标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA | |
| D. | 高温高压下,28gN2与6gH2反应,生成的NH3分子数为2nA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Fe3+ | Fe2+ | Cu2+ | |
| 开始沉淀时的pH | 2.7 | 7.6 | 5.2 |
| 完全沉淀时的pH | 3.7 | 9.6 | 6.4 |
| 第一次实验 | 第二次实验 | |
| 坩埚质量(g) | 14.520 | 14.670 |
| 坩埚质量+晶体质量(g) | 17.020 | 18.350 |
| 第一次加热、冷却、称量(g) | 16.070 | 16.989 |
| 第二次加热、冷却、称量(g) | 16.070 | 16.988 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| A | B | C | D |
| A12O3 | Si | Na2O2 | Na2SiO3 |
| 两性氧化物 | 单质 | 碱性氧化物 | 正盐 |
| 工业用电解法冶炼铝 | 制作太阳能电池 | 用于呼吸面具作为氧气的来源 | 制备硅胶 |
| A.A | B.B | C.C | D.D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
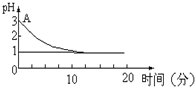 关于“电解氯化铜溶液时的pH值变化”问题,化学界有以下两种不同的观点:
关于“电解氯化铜溶液时的pH值变化”问题,化学界有以下两种不同的观点:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子晶体 | B. | 离子晶体 | C. | 原子晶体 | D. | 以上晶体都不是 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com