
 物之间两两皆能反应,均生成盐和水。请完成下列各小题:
物之间两两皆能反应,均生成盐和水。请完成下列各小题:科目:高中化学 来源:不详 题型:填空题
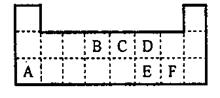
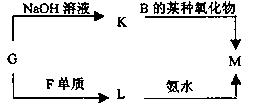
 化合物M是一种白色胶状沉淀,则M的化学式为 ;
化合物M是一种白色胶状沉淀,则M的化学式为 ;查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
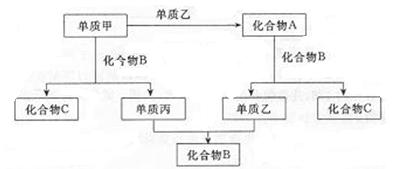
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 ;
; 族;
族; 物不污染环境,其化学方程式为 (不需要配平)。
物不污染环境,其化学方程式为 (不需要配平)。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
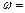 ______________(此空用数据列出表达式即可)。
______________(此空用数据列出表达式即可)。 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CH3CH3中的两个碳原子与BF3中的硼原子均采用SP2杂化 |
| B.晶体硅和石英(SiO2)晶体中的硅原子均采用SP3杂化 |
| C.BeCl2中的铍原子和 H2O中的氧原子均采用SP杂 |
| D.CO2中的碳原子与CH2=CH2中的两个碳原子均采用SP杂化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com