
【题目】下列说法错误的是( )
A.在CaF2晶体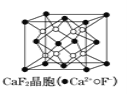 中,Ca2+的配位数是8
中,Ca2+的配位数是8
B.1mol金刚石晶体中,平均含有2molC—C键
C.HF、HCl、HBr、HI的热稳定性从左到右依次减弱
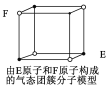
D.某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE
科目:高中化学 来源: 题型:
【题目】已知室温下,0.1 mol·L-1某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )
A.HA电离出的c(H+)与水电离出的c(H+)之比为108
B.升高温度,溶液的pH减小
C.溶液的pH=4
D.HA的电离平衡常数约为l×10-7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知反应2HI(g)=H2(g)+I2(g)的△H=+11kJ·mol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为______________kJ。
(2)已知某密闭容器中存在下列平衡:CO(g)+H2O(g)![]() CO2(g)+H2(g),CO的平衡物质的量浓度c(CO)与温度T的关系如图所示。
CO2(g)+H2(g),CO的平衡物质的量浓度c(CO)与温度T的关系如图所示。
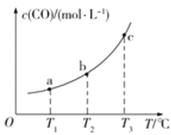
①该反应△H_____________0(填“>”或“<”)
②若T1、T2时的平衡常数分别为K1、K2,则K1_____________K2(填“>”、“<”或“=”)。
(3)在恒容密闭容器中,加入足量的MoS2和O2,仅发生反应:2MoS2(s)+7O2(g)![]() 2MoO3(s)+4SO2(g)ΔH。测得氧气的平衡转化率与起始压强、温度的关系如图所示:
2MoO3(s)+4SO2(g)ΔH。测得氧气的平衡转化率与起始压强、温度的关系如图所示:
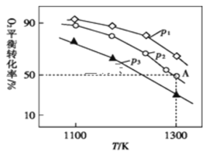
①p1、p2、p3的大小:___________。
②若初始时通入7.0molO2,p2为7.0kPa,则A点平衡常数Kp=___________(用气体平衡分压代替气体平衡浓度计算,分压=总压×气体的物质的量分数,写出计算式即可)。
(4)中科院兰州化学物理研究所用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃反应,所得产物含CH4、C3H6、C4H8等副产物,反应过程如图。
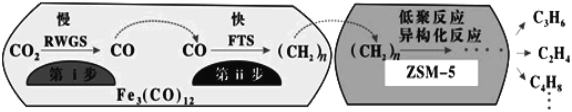
催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如表。
助剂 | CO2转化率(%) | 各产物在所有产物中的占比(%) | ||
C2H4 | C3H6 | 其他 | ||
Na | 42.5 | 35.9 | 39.6 | 24.5 |
K | 27.2 | 75.6 | 22.8 | 1.6 |
Cu | 9.8 | 80.7 | 12.5 | 6.8 |
①欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加_______助剂效果最好;加入助剂能提高单位时间内乙烯产量的根本原因是:___________
②下列说法正确的是______;
a.第ⅰ步的反应为:CO2+H2![]() CO+H2O
CO+H2O
b.第ⅰ步反应的活化能低于第ⅱ步
c.催化剂助剂主要在低聚反应、异构化反应环节起作用
d.Fe3(CO)12/ZSM-5使CO2加氢合成低碳烯烃的ΔH减小
e.添加不同助剂后,反应的平衡常数各不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO甲烷化反应为:CO(g)+3H2(g)=CH4(g)+H2O(l)。如图是使用某种催化剂时转化过程中的能量变化(部分物质省略),其中步骤②反应速率最慢。
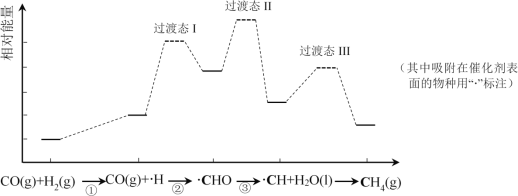
下列说法不正确的是( )
A.步骤①只有非极性键断裂
B.步骤②速率最慢的原因可能是其活化能最高
C.步骤③需要吸收热量
D.使用该催化剂不能有效提高CO的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向两只分别盛有50 mL0.100 mol/L盐酸的烧杯中各自匀速滴加50 mL蒸馏水、50 mL0.100 mol/L醋酸铵溶液,装置如图所示(夹持仪器等已略)。
已知:常温下,CH3COONH4溶液pH约为7。
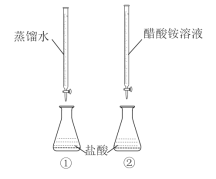
下列说法正确的是( )
A.实验①滴加过程中溶液所有离子浓度都减小
B.实验②滴至pH=2时,溶液中c(Cl-)+c(CH3COO-)+c(OH-)=0.01 mol/L
C.实验②滴加过程中,溶液中均存在c(CH3COO-)<c(NH4+)
D.滴定结束后,①中水的电离程度比②中大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是氯化铯晶体的晶胞(晶体中的最小重复单元),已知晶体中两个最近的Cs+离子核间距离为a cm,氯化铯的相对分子质量为M,NA为阿伏加德罗常数,则氯化铯晶体密度是( )

A. ![]() g/cm3 B.
g/cm3 B. ![]() g/cm3 C.
g/cm3 C. ![]() g/cm3 D.
g/cm3 D. ![]() g/cm3
g/cm3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三草酸合铁酸钾[K3Fe(C2O4)33H2O]是制备负载型活性铁催化剂的主要原料。某化学小组探究用废铁屑(含少量-2价S元素)为原料制备三草酸合铁(Ⅲ)酸钾晶体。具体流程如图:
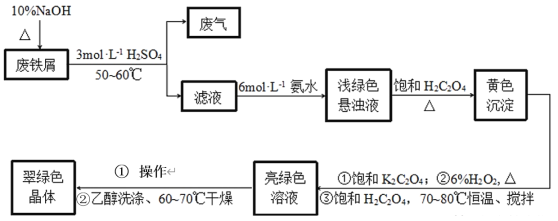
已知:①(NH4)2Fe(SO4)26H2O为蓝绿色晶体,FeC2O4·2H2O为难溶于水的黄色晶体,K3Fe(C2O4)3·3H2O为可溶于水、难溶于乙醇的翠绿色晶体。
②25℃时,[Fe(C2O4)3]3-(aq)+SCN-(aq)![]() [Fe(SCN)]2+(aq)+3C2O
[Fe(SCN)]2+(aq)+3C2O![]() (aq) K=6.31×10-17。
(aq) K=6.31×10-17。
③[Fe(SCN)]2+(aq)为血红色。
回答下列问题:
(1)三草酸合铁酸钾[K3Fe(C2O4)33H2O]中铁的化合价是_____。
(2)废铁屑中加入10%NaOH并加热的目的是__。
(3)为防止污染空气,反应所产生的“废气”可选择__净化处理。(填选项)
A.H2O B.NaOH溶液 C.盐酸 D.CuSO4溶液
(4)写出浅绿色悬浊液中加入饱和H2C2O4生成黄色沉淀的化学方程式:__。
(5)制备过程中加入6%H2O2的目的是__,温度保持70~80℃,采用的合适加热方式是__。
(6)获得翠绿晶体的操作①是___。
(7)用乙醇洗涤晶体的原因是___。
(8)某同学欲检验所制晶体中的Fe(Ⅲ),取少量晶体放入试管中,加蒸馏水使其充分溶解,再向试管中滴入几滴0.1molL-1KSCN溶液。请判断上述实验方案是否可行并说明理由:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学方程式的说法正确的是
A. H2的燃烧热为285.8 kJ·mol1,则表示H2燃烧的热化学方程式可表示为:H2(g)+ ![]() O2
O2![]() H2O(g) ΔH=285.8 kJ·mol1
H2O(g) ΔH=285.8 kJ·mol1
B. 中和热为57.3 kJ·mol1,则NaOH与醋酸反应的中和热可以表示如下:NaOH(aq)+CH3COOH(aq)![]() CH3COONa(aq)+H2O(l) ΔH=57.3 kJ·mol1
CH3COONa(aq)+H2O(l) ΔH=57.3 kJ·mol1
C. 已知:C(s,金刚石)+O2(g)![]() CO2(g) ΔH=395.4 kJ·mol1,C(s,石墨)+O2(g)
CO2(g) ΔH=395.4 kJ·mol1,C(s,石墨)+O2(g)![]() CO2(g) ΔH=393.5 kJ·mol1,则C(s,金刚石)
CO2(g) ΔH=393.5 kJ·mol1,则C(s,金刚石)![]() C(s,石墨)ΔH=1.9 kJ·mol1
C(s,石墨)ΔH=1.9 kJ·mol1
D. 已知1 mol CH4完全燃烧生成CO2和液态水放出890.4 kJ的热量,则该反应中转移1 mol电子时放出的热量为222.6 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一块表面无锈的铁片上滴食盐水,放置一段时间后看到铁片上有铁锈出现。铁片腐蚀过程中发生的总化学方程式:2Fe+2H2O+O2===2Fe(OH)2,Fe(OH)2进一步被氧气氧化为Fe(OH)3,再在一定条件下脱水生成铁锈,其原理如图。下列说法正确的是( )

A. 铁片发生还原反应而被腐蚀
B. 铁片腐蚀最严重区域应该是生锈最多的区域
C. 铁片腐蚀中负极发生的电极反应:2H2O+O2+4e-===4OH-
D. 铁片里的铁和碳与食盐水形成无数微小原电池,发生了电化学腐蚀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com