
科目:高中化学 来源:2015-2016学年山西忻州第一中学高二上期中考试化学试卷(解析版) 题型:实验题
某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol/L NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体______g。
(2)配制0.50 mol/L NaOH溶液必须用到的仪器有:天平(带砝码)、烧杯、玻璃棒、__________和____________。
Ⅱ.测定稀硫酸和稀氢氧化钠溶液中和热的实验装置如图所示。
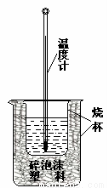
(1)该图中有两处未画出,它们是烧杯上方的泡沫塑料盖和_________________。泡沫塑料的作用是 。
(2)写出该反应的热化学方程式(中和热ΔH= -57.3 kJ/mol):_______________________________。
(3)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
实验次数] | 起始温度t1/ oC] | 终止温度t2/ oC] | 温度差平均值(t2-t1)/ oC] | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | |
2 | 27.0 | 27.4 | 27.2 | 31.2 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=________ kJ/mol (取小数点后一位)。
③上述实验数值结果与-57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)____________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北衡水冀州中学高二上月考三化学试卷(解析版) 题型:选择题
下列有关溶液的叙述中,正确的是( )
A.中和10 mL 0.1 mol·L-1 醋酸与中和100 mL 0.01 mol·L-1的醋酸所需同种碱溶液的量不同
B.常温下,等体积的pH=3的酸溶液和pH=11的碱溶液混合,混合后溶液的pH=7
C.常温下,体积相等、pH相同的盐酸和硫酸溶液,两溶液溶质的物质的量浓度相等
D.常温下,pH=3的甲酸溶液的c(H+)与pH=11的氨水溶液的c(OH-)相等
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建厦门一中高一上期中考试化学试卷(解析版) 题型:选择题
在物质分类中,前者包括后者的是
A.氧化物、化合物 B.盐、电解质 C.溶液、 胶体 D.分散系、溶液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建厦门一中高二上期中考试化学试卷(解析版) 题型:选择题
分子式为C5H10O2的有机物在酸性条件下可水解为酸和醇,若不考虑立体异构,这些酸和醇重新组合可形成的酯共有
A.40种 B.32种 C.28种 D.15种
查看答案和解析>>
科目:高中化学 来源:2015-2016学年北京顺义牛栏山一中高一上期中化学试卷(解析版) 题型:实验题
右图为实验室某浓盐酸试剂瓶标签上的数据,请根据有关数据回答下列问题:

(1)该浓盐酸的物质的量浓度是 mol/L。
(2)取用任意体积的浓盐酸时,下列物理量不随所取体积的多少而变化的是 。
A.溶液中HCl的物质的量 B. 溶液的浓度
C.溶液中Cl-的数目 D. 溶液的密度
(3)某学生用上述浓盐酸和蒸馏水,配制250mL物质的量浓度为0.400mol/L的稀盐酸。
①该学生需要量取 mL上述浓盐酸进行配制。如果实验室有5mL、10mL 、20mL、50mL量筒,应选用 mL量筒最好。
② 需要使用的实验仪器有:烧杯、玻璃棒 、量筒 、胶头滴管和 。
③ 配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在横线上填写偏大、偏小或无影响)
i)用量筒量取浓盐酸时俯视观察凹液面 。
ii)定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年北京顺义牛栏山一中高一上期中化学试卷(解析版) 题型:选择题
每摩尔物质含有
A.6.02×1023个分子 B.6.02×1023个原子
C.阿伏加德罗常数个原子 D.阿伏加德罗常数个该物质的粒子
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省高二上期中测试化学试卷(解析版) 题型:填空题
研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g);ΔH1=+489.0 kJ·mol-1
C(s)+CO2(g)=2CO(g);ΔH2=+172.5 kJ·mol-1。
则CO还原Fe2O3的热化学方程式为______________________
(2)某实验将CO2和H2充入一定体积的密闭容器中,在两种不同条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CH3OH的物质的量随时间的变化如图所示,请回答下列问题:
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CH3OH的物质的量随时间的变化如图所示,请回答下列问题:
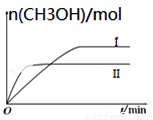
①该反应的平衡常数的表达式为K=___ ____。
②曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ _KⅡ(填“大于” 、“等于”或“小于”)。
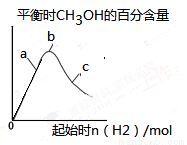
③在下图a、b、c三点中,H2的转化率由高到低的顺序是__________(填字母)。
(3)在其他条件不变的情况下,将容器体积压缩到原来的1/2,与原平衡相比,下列有关说法正确的是 。
a.氢气的浓度减小
b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加
d.重新平衡时n(H2)/n(CH3OH)增大
(4)在恒温恒容条件下,起始加入的反应物不变,要增大CH3OH 的产率,可以采取的有效措施是
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东寿光现代中学高二上12月月考化学卷(解析版) 题型:填空题
(1)有下列物质①Cu ②液态SO2 ③CH3COOH ④NaHCO3 ⑤H2O ⑥熔融NaCl ⑦BaSO4属于弱电解质的是________________(填序号);
(2)常温下,0.1 mol•L-1NaHCO3溶液的pH大于8,则溶液中的Na+、HCO3-、CO32-、OH-四种微粒的浓度由大到小的顺序为:________________;NaHCO3水解的离子方程式为_____________;
(3)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | HA物质的量浓度(mol•L-1) | NaOH物质的量浓度(mol•L-1) | 混合溶液的pH |
a | 0.1 | 0.1 | pH=9 |
b | c | 0.2 | pH=7 |
请回答:
①从a组情况分析,HA是强酸还是弱酸____________;
②b组情况表明,c_____0.2 (选填“>”、“<”或“=”).混合溶液中离子浓度c(A-)_________c(Na+);(选填“>”、“<”或“=”)
③a组实验所得混合溶液中由水电离出的c(OH-)=_______mol•L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com