
把一定浓度的NaOH溶液分成两等份,一份密闭保存,另一份敞口放置,几天后分别与相同浓度的盐酸反应,都恰好完全反应时,若第一份用去盐酸V1mL,第二份用去盐酸V2mL,则两者的关系为( )
A.V1=V2 B.V1>V2 C.V1<V2 D.不能确定
科目:高中化学 来源:2017届北京市昌平区高三上学期期末化学试卷(解析版) 题型:选择题
下列化学用语正确的是
A.硫离子的结构示意图:
B.FeSO3的名称是亚硫酸铁
C.电子转移情况: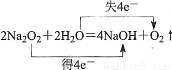
D.氮气分子的电子式: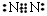
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江、吉林省两省六校高一上期中化学试卷(解析版) 题型:选择题
在标准状况下,将1mol H2和11.2 L O2混合,得到气体的体积为( )
A.12.2 L B.<22.4 L C.33.6 L D.无法确定
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江、吉林省两省六校高二上期中化学试卷(解析版) 题型:选择题
现有常温时pH=1的某强酸溶液10mL,下列操作能使溶液的pH变成2的是 ( )
A.加入10mL 0.01mol·L-1的NaOH溶液
B.加入10mL 的水进行稀释
C.加水稀释至100mL
D.加入10mL 0.01mol·L-1的盐酸溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江、吉林省两省六校高二上期中化学试卷(解析版) 题型:选择题
100℃时,将0.1 mol N2O4置于1L密闭的烧瓶中,然后将烧瓶放入100℃ 的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g)  2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是
2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是
①N2O4的消耗速率与NO2的生成速率之比为1:2 ;②NO2生成速率与NO2消耗速率相等;③烧瓶内气体的压强不再变化;④烧瓶内气体的质量不再变化;⑤NO2的物质的量浓度不再改变;⑥烧瓶内气体的颜色不再加深;⑦烧瓶内气体的平均相对分子质量不再变化;⑧烧瓶内气体的密度不再变化。
A.②③⑥⑦ B.①④⑧ C.只有①④ D.只有⑦⑧
查看答案和解析>>
科目:高中化学 来源:2017届广东省惠州市高三上第三次调研化学试卷(解析版) 题型:填空题
[物质结构与性质]氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解。
(1)溴的价电子排布式为 ;PCl3的空间构型为 。
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列 式发生:
A.CsICl2=CsCl+ICl B.CsICl2=CsI+Cl2
(3)根据下表第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是__________
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ•mol﹣1) | 1681 | 1251 | 1140 | 1008 |
(4)下列分子既不存在s﹣pσ键,也不存在p﹣pπ键的是
A. HCl B.HF C. SO2 D. SCl2
(5)已知COCl2为平面形,则COCl2中心碳原子的杂化轨道类型为 ,写出CO的等电子体的微粒 (写出1个)。
(6)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示:由此可判断该钙的氧化物的化学 式为 。已知该氧化物的密度是ρg•cm﹣3,则晶胞离得最近的两个钙离子间的距离为 cm(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
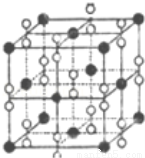
查看答案和解析>>
科目:高中化学 来源:2017届广东省惠州市高三上第三次调研化学试卷(解析版) 题型:选择题
常温时,向一定量的硫酸铜溶液中滴加pH=11 的氨水,当Cu2+完全沉淀时,消耗氨水的体积为V,下列说法正确的是(已知Ksp[Cu(OH)2] = 2.2×10-20)( )
A.若将氨水加水稀释,则稀释过程中,c(NH4+)/c(NH3? H2O)始终保持增大
B.滴加过程中,当溶液中c(Cu2+) = 2.2×10-2 mol/L 时,溶液的pH = 9
C.滴加过程中,当溶液的pH = 7 时,溶液中2c(NH4+)= c(SO42-)
D.若滴加pH = 11 的NaOH 溶液,Cu2+完全沉淀时消耗溶液的体积小于V
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省定西市通渭县高三上学期期末化学试卷(解析版) 题型:填空题
【化学--选修3物质结构与性质】元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p轨道上有4个电子.元素Z的原子最外层电子数是其内层的3倍.
(1)X与Y所形成化合物晶体的晶胞如图所示.
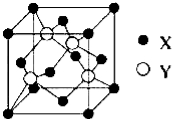
①在1个晶胞中,X离子的数目为 .
②该化合物的化学式为 .
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是 .
(3)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是 .
(4)Y与Z可形成YZ42﹣
①YZ42﹣的空间构型为 (用文字描述).
②写出一种与YZ42﹣互为等电子体的分子的化学式: .
(5)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2 ,1mol该配合物中含有σ键的数目为 .
,1mol该配合物中含有σ键的数目为 .
查看答案和解析>>
科目:高中化学 来源:2017届北京市海淀区高三上学期期末化学试卷(解析版) 题型:选择题
某同学利用右图所示装置制备乙酸乙酯。实验如下:
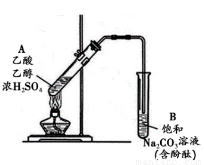
① 向浓H2SO4乙醇混合液中滴入乙酸后,加热试管A
② 一段时间后,试管B中红色溶液上方出现油状液体
③ 停止加热,振荡试管B,油状液体层变薄,下层红色溶液褪色
④ 取下层褪色后的溶液,滴入酚酞后又出现红色
结合上述实验,下列说法正确的是
A. ①中加热利于加快酯化反应速率,故温度越高越好
B. ③中油状液体层变薄主要是乙酸乙酯溶于Na2CO3溶液所致
C. ③中红色褪去的原因可能是酚酞溶于乙酸乙酯中
D. 取②中上层油状液体测其,共有3组峰
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com