

分析 废铁屑在碳酸钠溶液中洗涤除去表面的油污,小火加热用用倾析法分离洗涤铁屑,加入稀硫酸溶液水浴加热、趁热过滤,得到滤液中加入一定量硫酸铵固体,溶液表面出现晶膜时,停止加热,蒸干时溶液中的杂质离子会被带入晶体中,温度过高晶体分解被空气中氧气氧化,采取蒸发浓缩、冷却结晶方法,通过减压过滤(或抽滤)等得到较为干燥的晶体.
(1)Na2CO3溶液中CO32-水解使Na2CO3溶液呈碱性,油脂在碳酸钠溶液中水解生成溶于水的物质;
(2)硫酸溶液中的氢离子增多会抑制Fe2+的水解,亚铁离子容易被氧化成铁离子,反应未结束时还有铁屑,防止硫酸亚铁氧化变质,防止Fe2+被氧化为Fe3+,
(3)Fe2+易被氧化,加热煮沸蒸馏水一段时间,除去水中的氧气,防止Fe2+被氧化;
(4)亚铁离子具有还原性,易被氧化成铁离子,高锰酸钾溶液具有氧化性,能氧化亚铁离子为铁离子;
(5)MnO4-为紫色,当滴入最后一滴KMnO4溶液,紫色不褪去,说明滴定到终点;
(6)5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O,根据关系式5Fe2+~MnO4-计算;
(7)通过测定硫酸根离子的物质的量或铵根离子的物质的量进行测定.
解答 解:(1)Na2CO3溶液中CO32-水解CO32-+H2O?HCO3-+OH-,使Na2CO3溶液呈碱性,Na2CO3的主要作用是除去铁屑表面的油污,
故答案为:Na2CO3溶液水解显碱性便于除去铁屑表面的油污,CO32-+H2O?HCO3-+OH-;
(2)亚铁离子水解的方程式是:Fe2++2H20?Fe(0H)2+2H+;过量硫酸溶液中的氢离子会抑制Fe2+的水解,Fe2+易被氧化为Fe3+,氧化的Fe3+与Fe发生反应Fe+2Fe3+=3Fe2+,反应未结束时还有铁屑可防止Fe2+被氧化为Fe3+,
故答案为:硫酸过量可抑制Fe2+水解,反应未结束时还有铁屑可防止Fe2+氧化;
(3)水中溶有一定的氧气,氧气具有氧化性,(NH4)2Fe(SO4)2溶液中含有亚铁离子,Fe2+易被氧化,配制(NH4)2Fe(SO4)2溶液所用的蒸馏水,通常需加热煮沸一段时间后,冷却至室温再使用,这样操作可除去水中的氧气,防止Fe2+被氧化,
故答案为:除去水中的氧气,防止Fe2+被氧化;
(4)高锰酸钾与Fe2+的反应是MnO4-~Mn2+~5e-;Fe2+~Fe3+~e-;依据电子守恒,铁离子和亚铁离子前乘5,依据原子守恒和电荷守恒得到反应的离子方程式为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
故答案为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
(5)MnO4-为紫色,滴定终点时,加入最后一滴酸性高锰酸钾溶液的紫色不褪去,溶液由无色被紫色且30s内无变化,说明滴定到终点,
故答案为:滴入最后一滴KMnO4溶液时,锥形瓶内溶液变为紫色,且30s内不褪去;
(6)三次滴定测得酸性KMnO4溶液的用量平均值为VmL,消耗KMnO4的物质的量为V×10-3L×0.1000mol•L-1=V×10-4mol,MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,
n(Fe2+)=5V×10-4mol,则(NH4)2SO4•FeSO4•6H2O的质量为5V×10-4mol×392g/moL,硫酸亚铁铵样品的纯度为$\frac{5V×1{0}^{-4}mol×392g/moL×\frac{500mL}{25.00mL}}{mg}$×100%=$\frac{3.92V}{m}$×100%,
故答案为:$\frac{3.92}{m}$×100%;
(7)亚铁离子易被氧化,通过亚铁离子量的测定,计算(NH4)2SO4•FeSO4•6H2O的物质的量不准确,但硫酸根离子不被氧化,铵根离子在溶液中也不易被氧化,所以通过测定硫酸根离子的物质的量或铵根离子的物质的量来计算硫酸亚铁铵的量,
故答案为:通过测定硫酸根离子的物质的量或铵根离子的物质的量来计算硫酸亚铁铵的量.
点评 本题以莫尔盐的制备为载体,考查盐类水解、氧化还原反应、氧化还原反应滴定应用、物质分离提纯等有关实验操作以及在新情境下综合运用知识解决问题的能力.题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 内容 | 评价 |
| A | 一定条件下0.5molN2和1.5molH2反应,平衡时放热akJ, 则N2(g)+3H2(g)?2NH3(g)+2aKJ | 正确 |
| B | 氯化镁溶液与氨水反应:Mg2++2OH-→Mg(OH)2↓ | 错误,氨水不应写成离子形式 |
| C | 向硫酸铵溶液中加入氢氧化钡溶液:Ba2++SO42-→BaSO4↓ | 正确 |
| D | 等物质的量的Cl2与Na2SO3在溶液中反应:SO32-+Cl2→SO42-+2Cl- | 正确 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,c(H+)=10-13mol•L-1的溶液中:Na+、AlO2-、S2-、SO32- | |
| B. | 使pH试纸呈红色的溶液中:Fe2+、I-、NO3-、Cl- | |
| C. | 加入铝粉有氢气生成的溶液中:Mg2+、Cu2+、SO42-、K+ | |
| D. | 常温下,由水电离出的c(H+)•c(OH-)=1.0×10-26的溶液中:K+、Na+、HCO3-、Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
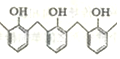 …的高聚物,其单体是甲醛和苯酚
…的高聚物,其单体是甲醛和苯酚
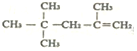 的名称为:2,4,4,-三甲基-1-戊烯
的名称为:2,4,4,-三甲基-1-戊烯| A. | 4 | B. | 5 | C. | 6 | D. | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学键的断裂与形成一定伴随着电子的转移和能量变化 | |
| B. | 碘晶体是分子晶体,加热升华过程中只需克服分子间作用力 | |
| C. | 二氧化硅晶体属于原子晶体,每个Si通过共价键与4个O结合 | |
| D. | 氯化钠的电离是一个破坏离子键的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Al3+、Cl-、HCO3-在溶液中能大量共存 | |
| B. | H2O2的电子式是: | |
| C. | AlCl3溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 铁锈是化合物,可用Fe2O3•nH2O(2<n<3)表示 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量CH3COONa固体 | B. | 通入少量HCl气体 | ||
| C. | 升高温度 | D. | 加入少量NaOH固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
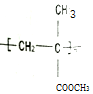 )缩写代号为PMMA.俗称有机玻璃.下列说法中错误的是( )
)缩写代号为PMMA.俗称有机玻璃.下列说法中错误的是( )| A. | 合成PMMA的单体是甲基丙烯酸和甲醇 | |
| B. | 聚甲基丙烯酸甲酯的分子式可表示为(C5H8O2)n | |
| C. | 聚甲基丙烯酸甲酯属于有机高分子合成材料 | |
| D. | 甲基丙烯酸甲酯[CH2=C(CH3)COOCH3]中碳原子可能都处于同一平面 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com