
| 族 周期 |
IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| ||
| ||


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源:不详 题型:问答题

| ② | |||
| ⑦ | ⑧ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 族 周期 |
IA | 0 | ||||||
| 1 | H | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | He |
| 2 | Li | Be | B | C | N | O | F | Ne |
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
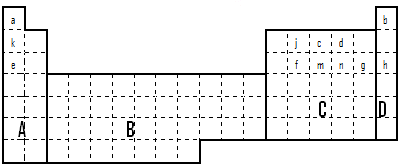
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.K+>Ca2+>Cl->S2- | B.Ca2+>K+>S2->Cl- |
| C.Ca2+<K+<Cl-<S2- | D.S2-<Cl-<K+<Ca2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
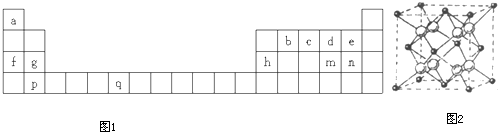
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:单选题
查看答案和解析>>
科目:高中化学 来源:专项题 题型:不定项选择题
[ ]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com