
【题目】按要求填空:
(1)CH2=CH C(CH3) =CH2系统命名为:____________________________。
(2)除去乙烷中少量的乙烯:____________________________。
(3)写出“间甲基苯乙烯”的结构简式 :____________________________。
 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】Na2O2是重要的化工原料,具有多种用途。
(1)写出CO2和Na2O2反应的化学方程式:___________________________________。
(2)某学生判断SO2和Na2O2反应能生成硫酸钠,你认为他的判断合理吗?__________,简要说明理由:_______________________________________________。
(3)该同学无法断定反应中是否有氧气生成,拟使用如图所示装置进行实验(图中铁架台等装置已略去)。
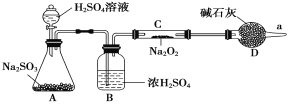
装置中B的作用是_________________,D的作用是_____________________。
(4)将足量的Na2O2投入到含有下列离子的溶液中:NO3-、S2-、HCO3-、CO32-、Na+,设反应完毕后,无固体析出,则上述离子数目减少的有__________,数目增多的离子有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成S、C、Si三种元素的非金属性强弱比较的实验研究。乙同学设计了如图装置来验证卤族元素的性质递变规律,A、B、C三处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。

(1)如图中仪器A的名称是____。甲同学实验步骤:连接仪器、______、加药品、滴入试剂。
(2)①如图中仪器A中盛放试剂稀硫酸,烧瓶B中的盛放试剂为___溶液,C中的盛放试剂为______溶液。
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是_________。
(3)如图中A处反应的离子方程式为__________。
(4)乙同学发现如图中B处试纸变蓝,C处红纸褪色,据此____(填“能”或“不能”)得出溴的非金属性强于碘,理由是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列装置或操作描述正确的是( )
A.  用于实验室制乙烯
用于实验室制乙烯
B. 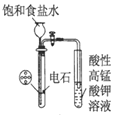 用于实验室制乙炔并检验乙炔
用于实验室制乙炔并检验乙炔
C.  用于实验室中分馏石油
用于实验室中分馏石油
D.  中A为醋酸,B为碳酸钙,C为苯酚钠溶液,则可验证酸性:醋酸>碳酸>苯酚
中A为醋酸,B为碳酸钙,C为苯酚钠溶液,则可验证酸性:醋酸>碳酸>苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可由乙苯生产苯乙烯:![]() ,下列说法正确的是
,下列说法正确的是
A. 该反应的类型为消去反应
B. 乙苯的同分异构体共有三种
C. 可用酸性高锰酸钾溶液鉴别乙苯和苯乙烯
D. 乙苯和苯乙烯分子内共平面的碳原子数均为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10 mL 0.1 mol·L-1 NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是
A.x=10时,溶液中有NH4+、Al3+、SO42-,且c(NH4+)=c(Al3+)
B.x=20时,溶液中所发生反应的离子方程式为Al3++2SO42-+2Ba2++4OH-=AlO2-+2H2O+2BaSO4↓
C.x=30时,溶液中有Ba2+、AlO2-、OH-,且c(OH-)<c(AlO2-)
D.滴加过程中,生成沉淀的最大物质的量为0.003 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于放热反应Zn+H2SO4===ZnSO4+H2↑,下列叙述正确的是( )
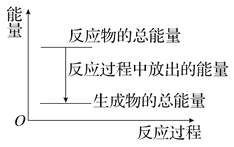
A. 反应过程中的能量关系可用上图表示
B. 1 mol Zn的能量大于1 mol H2的能量
C. 若将其设计为原电池,则锌作正极
D. 若将其设计为原电池,当有32.5 g Zn溶解时,正极放出的气体一定为11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断A(g)+B(g) ![]() C(g)+D(g)是否达到平衡的依据为( )
C(g)+D(g)是否达到平衡的依据为( )
A. 压强不随时间改变
B. 气体的密度不随时间改变
C. c(A)不随时间改变
D. 单位时间里生成C和D的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,回答下列问题:
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)③、④、⑤的原子半径由大到小的顺序为______(用元素符号回答)。
(2)②、③、⑦的最高价氧化物对应的水化物酸性由强到弱的顺序是_____。(用化学式回答)
(3)由①、④、⑤三种元素形成化合物的电子式______ 。
(4)⑥的单质与NaOH溶液反应的离子方程式_______。
(5)⑦的氢化物是一种无色气体,遇到空气能发生爆炸性自燃。已知室温下1 g氢化物自燃放出45.0 kJ的热量(产物水为液态),其热化学方程式为_________。
(6)由表中元素形成的常见物质A、B、C、D、E、F转化关系如下图所示。已知:A是常见的气态氢化物,B是能使带火星的木条复燃的无色无味气体, E的相对分子质量比D大17 ,D为红棕色气体(部分反应中生成物没有全部列出,反应条件未列出)

①A的结构式为_______。
②A和B反应生成C和F的化学方程式为_______,反应Ⅰ的离子方程式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com