
黄铁矿主要成分是FeS2。某硫酸厂在进行黄铁矿成分测定时,取0.1000 g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2 (SO4)3溶液完全反应后,用浓度为0.02000 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液2 5.00 mL。
5.00 mL。
已知: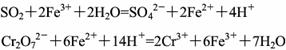
(1)样品中FeS2的质量分数是(假设杂质不参加反应) 。
(2)若灼烧6 g FeS2产生的SO2全部转化为SO3气体时放出9.83 kJ热量,产生的SO3与水全部化合生成H2SO4,放出13.03 kJ热量,写出SO3气体转化为H2SO4的热化学方程式: 。
(3)煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为 L,制得98%的硫酸质量为 t,SO2全部转化为H2SO4时放出的热量是 kJ。
【答案】
(1)90.00%
(2)SO3(g)+H2O(l)=H2SO4(l);△H=-130.3 kJ/mol
(3)3.36×106 15 3.43×107
【解析】本题主要考查考生应用物质的量、物质的量浓度、气体摩尔体积等进行综合计算的能力。
(1)由反应4FeS2+11O2 2Fe2O3+8SO2及题目所给的两个离子反应方程式,可得下列关系式:
2Fe2O3+8SO2及题目所给的两个离子反应方程式,可得下列关系式:
FeS2 ~ 2SO2 ~ 4Fe2+ ~  Cr2O
Cr2O
120 g  mol
mol
m(FeS2) 25.00×10-3 L×0.020 00 mol·L-1
解得m(FeS2)=0.090 0 g
所以w(FeS2)=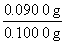 ×100%=90.00%
×100%=90.00%
(2)n(FeS2)= =0.05 mol,完全燃烧时可产生0.1 mol SO2。1 mol SO3完全与水化合放出的热量为130.3 kJ,则SO3气体转化为H2SO4的热化学方程为SO
=0.05 mol,完全燃烧时可产生0.1 mol SO2。1 mol SO3完全与水化合放出的热量为130.3 kJ,则SO3气体转化为H2SO4的热化学方程为SO 3(g)+H2O(l)===H2SO4(l);ΔH=-130.3 kJ·mol-1。
3(g)+H2O(l)===H2SO4(l);ΔH=-130.3 kJ·mol-1。
(3)4FeS2+11O2 Fe2O3+8SO2
Fe2O3+8SO2
4×120 t 8×22.4×103 L
10 t×90% V(SO2)
解得:V(SO2)=3.36×106 L
又由2SO2+O2 2SO3,及SO3+H2O===H2SO4得
2SO3,及SO3+H2O===H2SO4得
FeS2 ~ 2H2SO4
120 2×98
10 t×90% m(H2SO4)·98%
解之得m(H2SO4)=15 t
SO2全部转化为H2SO4时放出的热量包括两部分:SO2转化为SO3时放出的热量和SO3与H2O化合为H2SO4时放出的热,按上述(2)中的关系不难求解。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
1体积某气态烃和2体积氯化氢发生加成反应后,最多还能和6体积氯气发
生取代反应。由此可以断定原气态烃是(气体体积均在相同条件下测定)
A.乙炔 B.丙炔 C.丁炔 D.丁二烯
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各项中,表达正确的是 ( )
A.甲醛的结构简式:HCOH B. C2H2分子的结构式:CH≡CH
 C.CH4分子的比例模型:
C.CH4分子的比例模型: D.异丁烷的键线式:
D.异丁烷的键线式:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F、G、H均为有机化合物。

根据上图回答问题:
⑴ D的化学名称是 。
⑵ D在一定条件下与O2反应生成H,H可发生银镜反应。H发生银镜反应的化学方程式_____________________________________________。
⑶ B的分子式是 ,A的结构简式是 ,反应①的反应类型是 。
⑷ 符合下列3个条件的B的同分异构体的数目有_______个。
①含有邻二取代苯环结构 ②与B有相同官能团 ③不与FeCl3溶液发生显色反应
写出其中一个同分异构体的结构简式___________________。
⑸ G是重要的工业原料,用化学方程式表示G的一种重要的工业用途
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:(1)Zn(s)+1/2O2(g)==ZnO(s),ΔH=-348.3kJ/mol
(2) 2Ag(s)+1/2 O2(g)== Ag2O(s),ΔH=-31.0kJ/mol
则Zn(s)+ Ag2O(s)== ZnO(s)+ 2Ag(s)的ΔH等于
A.-317.3kJ/mol B. -379.3kJ/mol
-379.3kJ/mol
C.-332.8 kJ/mol D.317.3 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组热化学方程式中,化学反应的△H前者大于后者的是
①C(s)+O2(g)==CO2(g);△H1 C(s)+ O2(g)==CO(g);△H2
O2(g)==CO(g);△H2
②S(s)+O2(g)==SO2(g);△H3 S(g)+O2(g)==SO2(g);△H4
③H2(g)+ O2(g)==H2O(l);△H5 2H2(g)+O2(g)==2H2O(l);△H6
O2(g)==H2O(l);△H5 2H2(g)+O2(g)==2H2O(l);△H6
④CaCO3(s)==CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)==Ca(OH)2(s);△H8
A.① B.④ C.②③④ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关能量转换的说法正确的是( )
A.煤燃烧是化学能转化为热能的过程
B.化石燃料和植物燃料燃烧时放出的能量均来源于太阳能
C.动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程
D.植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
室温时,两个容积相同的烧瓶中分别盛有M和N两种气体(同温同压),取下弹簧夹A,使两烧瓶内的气体接触(如图),容器内的压强由大到小的顺序是
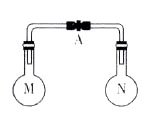
| 编号 | ① | ② | ③ | ④ |
| 气体M | H2S | H2 | N H2 | NO |
| 气体N | SO2 | Cl2 | HCl | O2 |
A.①②③④ B.②④①③ C.④①②③ D.①④③②
查看答案和解析>>
科目:高中化学 来源: 题型:
CaCO3广泛存在于自然界,是一种重要的化工原料。大理石主要成分为CaCO3,另外有少量的含硫化合物。实验室用大理石和稀盐酸反应制备CO2气体。下列装置可用于CO2气体的提纯和干燥。
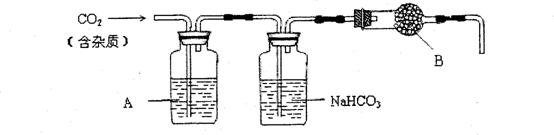
完成下列填空:
1)用浓盐酸配制1:1(体积比)的稀盐酸(约6 mol.L-1),应选用的仪器是 。
a.烧杯 b.玻璃棒 c.量筒 d.容量瓶
2)上述装置中,A是 溶液,NaHCO3溶液可以吸收 。
3)上述装置中,b物质是 。用这个实验得到的气体测定CO2的分子量,如果B物质失效,测定结果 (填“偏高”、“偏低”或“不受影响”)。
4)一次性饭盒中石蜡(高级烷烃)和CaCO3在食物中的溶出量是评价饭盒质量的指标之一,测定溶出量的主要实验步骤设计如下:
剪碎、称重→浸泡溶解→过滤→残渣烘干→冷却、称重→恒重
为了将石蜡和碳酸钙溶出,应选用的试剂是 。
a.氯化钠溶液 b.稀醋酸 c.稀硫酸d 正已烷
5)在溶出量测定实验中,为了获得石蜡和碳酸钙的最大溶出量,应先溶出 后溶出 。
6)上述测定实验中,连续 ,说明样品已经恒重。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com