
【题目】某溶液中含有Cl-、CO32-、HCO3-、OH-等四种阴离子,加入足量的Na2O2固体后,溶液中离子浓度基本保持不变的是(假设溶液体积无变化)
A.OH - B.HCO3- C.CO32- D.Cl-
科目:高中化学 来源: 题型:
【题目】七水硫酸镁(MgSO4·7H2O)为白色细小四角柱状结晶,无臭,味苦,在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣一硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、CaO、B2O3、Al2O3、MnO等)。
表1部分阳离子以氢氧化物形式完全沉淀时溶液的pH
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)3 | Mn(OH)2 | Mg(OH)2 |
pH值 | 4.7 | 3.2 | 9.7 | 10.4 | 11.2 |
表2两种盐的溶解度(单位为g/100g水)
温度/℃ | 10 | 30 | 40 | 50 | 60 |
CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 | — |
硼镁泥制取七水硫酸镁的工艺流程如下

根据以上流程图并参考表格数据,试回答下列问题:
(1)在酸溶过程中,想加快酸溶速度,提出两种可行的措施_______________。
(2)沉淀A中除二氧化硅外,还含有硼酸(H3BO3),硼酸微溶于水,为一元弱酸,其酸性不来源于羟基的电离,写出硼酸水溶液电离方程式____________________
(3)经对沉淀B进行分析,发现其中含有二氧化锰,用离子方程式解释产生二氧化锰原因:__________________。
(4)加入硼镁泥调节pH=5~6目的是________________。
(5)得到的沉淀C的组成是_________________(填化学式),过滤Ⅲ需趁热过滤,原因是___________。
(6)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】未来新能源的特点是资源丰富,在使用时对环境无污染或很少污染,且可以再生.下列最有希望的新能源是( )
①天然气 ②煤 ③石油 ④太阳能 ⑤氢能.
A. ①③⑤B. ②③④C. ①②⑤D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HCl、Na2O2、Al2O3 三种物质在水中完全反应后,溶液中只含有Na+、H+、Cl-、OH-;且溶液呈中性,则Na2O2、HCl、Al2O3的物质的量之比可能为( )
A. 3:2:1 B. 2:3:1 C. 4:2:1 D. 2:4:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列现象与胶体的性质无关的是
A. 将盐卤或石膏加入豆浆,制成豆腐
B. 向FeCl3溶液中加入NaOH溶液,会出现红褐色沉淀
C. 一枝钢笔使用两种不同型号的蓝黑墨水,易出现堵塞
D. 清晨,人们经常看到的阳光穿过茂密的树木枝叶所产生的美丽景象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为CH4燃料电池的装置(A、B为多孔碳棒):

(1)_____(填A或B)处电极入口通甲烷,其电极反应式为_____________;
(2)当消耗甲烷的体积为11.2 L(标准状况下)时,消耗KOH的质量为_______g。
(3)铅蓄电池是最早使用的充电电池,由Pb、PbO2、硫酸构成。该电池工作时,正极的电极反应为____________________。
(4)500 mL KNO3和Cu(N03)2的混合溶液中c(NO3-)=6.0 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL。原混合溶液中c(K+)为_________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品。工业上用粗氧化铜(含Fe2O3、FeO、Cu2O以及少量不溶性杂质)为原料制取氯化铜晶体 (CuCl2·2H2O)的为生产流程如下:

己知:Cu2O在酸性环境中可以生成Cu2+和Cu 回答下列问题:
(1)己知“浸渣”中不含铜单质,写出Cu2O在“盐酸浸出”中发生反应的化学方程式:___________________________________________
(2)“盐酸浸出”中,铜的浸出率与浸出时间的关系如下图所示。由图可得出如下变化规律:

①____________________________
②______________________________。
(3)“净化除杂”需先加入C1O2,其作用是(用离子方程式表示)______________。
然后再调节溶液的pH约为4,可选用的试剂是(填选项字母)______________。
A. CuSO4 B.CuO C.Cu2(OH)2CO3 D.NH3·H2O
(4)“操作I”包含多步实验基本操作,依次是__________、洗涤和风干等。工业上常采用无水乙醇代替水进行洗涤的主要原因是______________。
(5)为了测定制得的氯化铜晶体(CuCl2·xH2O)中x值,称取ag晶体,加入足量10%的氢氧化钠溶液,过滤、洗涤后,用酒精灯加热至质量不再减轻为止,冷却、称量所得固体质量为bg。计算得x= ______________。(用含a、b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表是元素周期表的一部分,表中所列的字母分别代表一种化学元素.试回答下列问题:
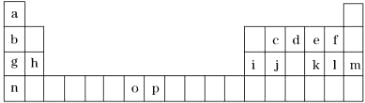
(1)元素o为25号元素,请写出其基态原子的电子排布式______.
(2)d与a反应的产物的分子中,中心原子的杂化形式为______.
(3)d、e、f三种元素的电负性大小顺序为(用元素符号表示)_________________.
(4)o、p两元素的部分电离能数据列于下表:

比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难.对此,你的解释是______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com