
| A. | 浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2 | |
| B. | 向FeCl3溶液中加Mg(OH)2:3 Mg(OH)2+2Fe3+=2Fe(OH)3+3 Mg2+ | |
| C. | NaHCO3溶液与稀H2SO4反应:CO32-+2H+=H2O+CO2↑ | |
| D. | 钠与CuSO4溶液反应:2Na+Cu2+=Cu↓+2Na+ |
分析 A.反应生成氯化亚铁和氢气;
B.发生沉淀的转化;
C.碳酸氢根离子不能拆分;
D.反应生成硫酸钠、氢氧化铜、氢气.
解答 解:A.浓盐酸与铁屑反应的离子反应为Fe+2H+=Fe2++H2↑,故A错误;
B.向FeCl3溶液中加Mg(OH)2的离子反应为3 Mg(OH)2+2Fe3+=2Fe(OH)3+3 Mg2+,故B正确;
C.NaHCO3溶液与稀H2SO4反应的离子反应为HCO3-+H+=H2O+CO2↑,故C错误;
D.钠与CuSO4溶液反应的离子反应为2Na+2H2O+Cu2+=Cu(OH)2↓+H2↑+2Na+,故D错误;
故选B.
点评 本题考查离子反应书写的正误判断,为高频考点,把握常见离子之间的反应为解答的关键,侧重氧化还原反应、沉淀转化的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | M层电子数是K层的三倍 |
| X | 最高化合价为+7价 |
| Y | 短周期主族元素原子中半径最大 |
| Z | 地壳中含量最多的金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3和H2SO4 | B. | NaHSO4和Ba(OH)2 | C. | NaAlO2和H2SO4 | D. | AlCl3和NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
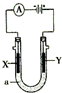 电解原理在化学工业中有广泛应用,如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.下列正确的是( )
电解原理在化学工业中有广泛应用,如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.下列正确的是( )| A. | 若X、Y为石墨,a为饱和NaCl溶液,向Y极附近加入酚酞,则Y极溶液呈红色 | |
| B. | 若X、Y是石墨,a为AgNO3溶液,电解一段时间后,溶液的pH减小 | |
| C. | 若用电解方法精炼粗铜,电解液a选用CuSO4溶液,X电极的材料是粗铜 | |
| D. | 若Y为铁,X为石墨,a为稀硫酸,Y电极反应为Fe-3e-=Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与少量乙二醛混合可制备乙二酸 | |
| B. | 与浓盐酸反应的离子方程式为:2MnO4-+16 H++10Cl-=5Cl2↑+2Mn2++8 H20 | |
| C. | 与K+、NO3-、SO42-、CO32-可以大量共存 | |
| D. | 与过量Na202混合后,共转移e-0.05mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2FeO4在酸性溶液中不稳定,与水反应生成Fe3+和O2,离子方程式为:4FeO42-+10H2O+4Fe3+=20OH-+3O2↑ | |
| B. | 工业上可用FeCl3、NaOH、NaClO三种物质反应制得NaFeO4离子方程式为:2Fe3++10OH-+3ClO-=2FeO42-+3Cl-+5H2O | |
| C. | NaFeO4消毒杀菌时得到的Fe3+可以净水,Fe3+能产生净水物质的原因是:Fe3++3H2O?Fe(OH)3+3H+ | |
| D. | 工业上可用铁做阳极,电解浓NaOH溶液的方法制Na2FeO4,阳极的电极反应为:Fe-6e-+8OH-=FeO42-+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H8O2属于酯的同分异构体 | B. | C5H10O2属于酸的同分异构体 | ||
| C. | 甲苯的一氯取代物 | D. | 化合物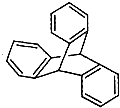 的一氯取代物 的一氯取代物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:3 | B. | 1:2 | C. | 3:1 | D. | 1:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com