
【题目】现有![]() 、
、![]() 两种溶液,选择填空:
两种溶液,选择填空:
A. ![]()
(1)当它们pH相同时,其物质的量浓度______.
(2)当它们的物质的量浓度相同时,其pH的关系是______.
(3)中和等体积、等物质的量浓度的烧碱溶液,需同物质的量浓度的两种酸溶液的体积关系为______.
(4)体积和物质的量浓度相同的![]() 、
、![]() 两溶液,分别与同浓度的烧碱溶液反应,要使反应后的溶液呈中性,所需烧碱溶液的体积关系为______.
两溶液,分别与同浓度的烧碱溶液反应,要使反应后的溶液呈中性,所需烧碱溶液的体积关系为______.
(5)当它们pH相同、体积相同时,分别加入足量锌,相同状况下产生气体体积关系为______.
(6)将pH相同的两种酸均稀释10倍后,pH关系为______.
【答案】 A A C B A B
【解析】试题分析:醋酸是弱酸,只能部分电离;盐酸是强酸,完全电离;中和相同物质的量的氢氧化钠需要盐酸、醋酸的物质的量相同;
解析:根据以上分析,(1)醋酸部分电离、盐酸完全电离,所以pH相同时,即氢离子浓度相同时,其物质的量浓度醋酸大于盐酸,选A;(2)醋酸部分电离、盐酸完全电离,物质的量浓度相同时,氢离子浓度盐酸大于醋酸,其pH的关系是醋酸大于盐酸,选A;(3)中和等体积、等物质的量浓度的烧碱溶液,需盐酸和醋酸的物质的量相同,需同浓度的两种酸溶液的体积关系盐酸等于醋酸,选C;(4)体积和物质的量浓度相同的![]() 、
、![]() 两溶液,醋酸、盐酸的物质的量相同,若恰好完全反应,消耗氢氧化钠的体积相同,此时醋酸钠呈碱性,所以要使反应后的溶液呈中性,所需烧碱溶液的体积关系为盐酸大于醋酸,选B;(5)当它们pH相同时,醋酸浓度大于盐酸;当它们pH相同、体积相同时,醋酸物质的量大于盐酸,加入足量锌,生成氢气的体积醋酸大于盐酸,选A;(6)加水稀释,促进弱酸电离,所以将pH相同的两种酸均稀释10倍后,pH关系为盐酸大于醋酸,选B。
两溶液,醋酸、盐酸的物质的量相同,若恰好完全反应,消耗氢氧化钠的体积相同,此时醋酸钠呈碱性,所以要使反应后的溶液呈中性,所需烧碱溶液的体积关系为盐酸大于醋酸,选B;(5)当它们pH相同时,醋酸浓度大于盐酸;当它们pH相同、体积相同时,醋酸物质的量大于盐酸,加入足量锌,生成氢气的体积醋酸大于盐酸,选A;(6)加水稀释,促进弱酸电离,所以将pH相同的两种酸均稀释10倍后,pH关系为盐酸大于醋酸,选B。


科目:高中化学 来源: 题型:
【题目】能源问题是人类社会面临的重大课题,H2、CO、CH3OH都是重要的能源物质,它们的燃烧热依次为285.8kJ·mol-1、282.5kJ·mol-1、726.7kJ·mol-1。已知CO和H2在一定条件下可以合成甲醇CO(g)+2H2(g)===CH3OH(l)。则CO与H2反应合成甲醇的热化学方程式为( )
A.CO(g)+2H2(g)===CH3OH(l) ΔH=-127.4kJ·mol-1
B.CO(g)+2H2(g)===CH3OH(l) ΔH=+127.4kJ·mol-1
C.CO(g)+2H2(g)===CH3OH(g) ΔH=-127.4kJ·mol-1
D.CO(g)+2H2(g)===CH3OH(g) ΔH=+127.4kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将饱和FeCl3溶液滴入沸水时,液体变为红褐色,得到的是Fe(OH)3胶体。用此分散系进行实验:
(1)请写出制备Fe(OH)3胶体的化学方程式____________________________________________。
(2)证明有 Fe(OH)3 胶体生成的实验操作是用一束光照射此液体,可以看到有光亮的通路,利用的胶体性质是______________。
(3)将Fe(OH)3 胶体装入U形管内,用石墨做电极,接通直流电源,通电一段时间后发现阴极附近颜色加深,这种现象叫_____。
(4)向Fe(OH)3 胶体中逐滴加入稀硫酸,可以看到有红褐色沉淀产生,因为胶体发生了_______,继续滴加稀硫酸直至过量,可以看到的实验现象是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了以下流程来检验碳酸钠粉末中可能含有少量氯化钠和氢氧化钠中的一种或两种杂质。

(1)步骤1所需玻璃仪器是_________;步骤3的操作名称是____________。
(2)对检验碳酸钠粉末中可能含有的杂质提出合理假设:
假设1:只含有氯化钠;
假设2:只含有____________;
假设3:氯化钠和氢氧化钠都含有。
(3)设计实验方案,进行实验。
限选以下试剂:氯化钡溶液、硝酸钡溶液、酚酞试液、稀硝酸、稀盐酸、稀硫酸、硝酸银溶液。回答下列问题:
①加入过量试剂A的名称是___________。
②填写下表:______
实验步骤 | 预期现象和结论 |
步骤4: | ①若,则假设成立 ②若,则成立 |
步骤5: |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的HCl和NaOH的物质的量之比是( )
A.1:1
B.2:1
C.1:3
D.3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸浸法制取硫酸铜的流程示意图如下

(1)步骤(i)中Cu2(OH) 2CO3 发生反应的化学方程式为______________________。
(2)步骤(ii)所加试剂起调节pH 作用的离子是___________________(填离子符号)。
(3)在步骤(iii)发生的反应中,1 mol MnO2转移2 mol 电子,该反应的离子方程式为______________________。
(4)步骤(iv)除去杂质的化学方程式可表示为:3Fe3++NH4++2SO42-+6H2O=NH4Fe3(SO4)2(OH)6+6H+过滤后母液的pH=2.0,c(Fe3+)=a mol·L-1,c (NH4+)=b mol·L-1,c(SO42-)= d mol·L-1,该反应的平衡常数K=__________(用含a 、b 、d 的代数式表示)。
(5)化学镀的原理是利用化学反应生成金属单质沉积在镀件表面形成镀层。
① 若用CuSO4进行化学镀铜,应选用 ______________(填“氧化剂”或“还原剂”)与之反应。
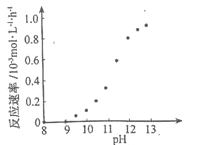
② 某化学镀铜的反应速率随镀液pH 变化如图所示。该镀铜过程中,镀液pH 控制在12.5左右。据图中信息,给出使反应停止的方法:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能大量共存的是( )
A.无色溶液中:Na+、Cu2+、NO3﹣、Cl﹣
B.在pH=4的溶液中:Na+、K+、OH﹣、Cl﹣
C.在含Ba2+的溶液中:H+、Na+、Cl﹣、SO42﹣
D.与Fe反应产生气体的溶液:Na+、K+、Cl﹣、SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,m g气体A与n g气体B的分子数目一样多,下列说法不正确的是( )
A. 在任意条件下,若两种分子保持原组成,则其相对分子质量之比为m∶n
B. 25 ℃、1.25×105 Pa时,两气体的密度之比为n∶m
C. 同质量的A、B在非标准状况下,其分子数之比为n∶m
D. 相同状况下,同体积的气体A与B的质量之比为m∶n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入1molN2,右边充入一定量的CO时,隔板处于如图位置(保持温度不变),下列说法正确的是( )

A.右边与左边分子数之比为4:1
B.右侧CO的质量为5.6 g
C.右侧气体密度是相同条件下氢气密度的14倍
D.若改变右边CO的充入量而使隔板处于容器正中间,保持温度不变,则应充入22.4 L的CO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com