

| ||
| ||
| ||
| ||
| 0.06g |
| 0.1g |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:山东省济宁市一中2011届高三一轮复习质量验收化学试题 题型:058
Ⅰ无水氯化铝是某些有机化学反应中常用的催化剂,它的熔点190℃,但在180℃时已开始升华.它在常温下是一种白色固体,遇水发生剧烈的水解反应,甚至在空气中遇到微量水汽也强烈地发烟.用下列装置制取无水氯化铝:
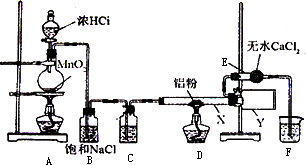
回答以下问题:
(1)装置D中发生的化学反应方程式:________.
(2)仪器X与仪器Y直接相连的意图是:
①收集产物
②________.
(3)能否去掉E装置________原因是________.
(4)实验时应先点燃________处的酒精灯,其作用是________.
Ⅱ.某种胃药中止酸剂为CaCO3.为测定其中CaCO3的含量,某化学小组设计了以下方案(药片中的其他成分与HCl和NaOH溶液均不反应):
用滴定法测定,有以下几步操作:
A.配制0.100 mol/L HCl溶液和0.100 mol/L NaOH溶液
B.取一粒药片(0.100 g),研碎后加入20.0 mL蒸馏水
C.以酚酞为指示剂用0.100 mol/L NaOH溶液滴定,用去NaOH溶液VmL时达到终点
D.用酸式滴定管加入25.00 mL 0.100 mol/L HCl溶液,充分反应
请回答有关问题:
(1)测定过程的正确操作顺序为________(填字母).
(2)经测定,每次消耗NaOH溶液体积的平均值为13.00 mL,则该胃药中CaCO3的质量分数是________.
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省临沂市高三上学期期中考试化学试卷(解析版) 题型:实验题
无水氯化铝是一种重要的化工原料,利用明矾石 制备无水氯化铝的流程如下:
制备无水氯化铝的流程如下:
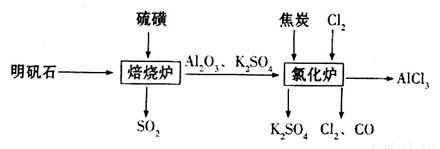
(1)验证焙烧炉产生的气体含有 的方法是________________________________。
的方法是________________________________。
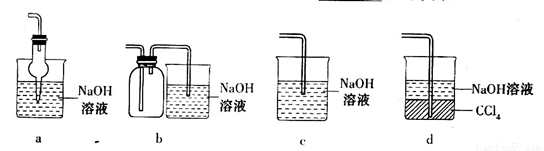
(2)吸收焙烧炉中产生的 ,下列装置合理的是________(填代号)。
,下列装置合理的是________(填代号)。
(3)氯化炉中发生反应的化学方程式为_________________________________________。
(4)生产氯化铝的过程中产生 等大气污染物,若将二者按照一定比例通入水中可减少或消除污染。试设计简单实验检验二者是否恰好完全反应。(简要描述实验步骤、现象和结论)
等大气污染物,若将二者按照一定比例通入水中可减少或消除污染。试设计简单实验检验二者是否恰好完全反应。(简要描述实验步骤、现象和结论)
__________________________________________________________________________。
仪器自选;可供选择试剂如下:
①滴加酚酞的氢氧化钠溶液 ②氯化亚铁溶液 ③硫氰化钾溶液 ④品红溶液
(5)某学习小组设计用如下装置验证二氧化硫的某些化学性质。

①能说明二氧化硫具有氧化性的实验现象为_____________________________________。
②写出a瓶中发生反应的离子方程式___________________________________________。
③充分反应后,取a瓶中的溶液分成三份,分别进行如下实验。
实验I:向第一份溶液中加入足量的NaOH溶液,生成白色沉淀,迅速变为灰绿色,最终变为红褐色
实验II:向第二份溶液中加入少量KMnO4溶液,紫色褪去
实验III:向第三份溶液中加入BaC12溶液,生成白色沉淀
上述实验中能证明二氧化硫具有还原性的是________(填实验代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
无水氯化铝是白色晶体,易吸收水分,在178℃升华,装有无水氯化铝试剂瓶久置潮湿空气中,会自动爆炸产生大量白雾,氯化铝常作为有机合成和石油工业的催化剂等。
如图是实验室制取少量无水氯化铝装置的一部分,在方框中安装某些仪器,便是该装置的另一部分,从A口通入某种气体,即可制取无水氯化铝。现提供的试剂除装置中已有的铝粉和碱石灰外,还有NaCl固体、MnO2、浓H2SO4和水,而提供的安装方框中装置的仪器不限,用上述方法制取无水氯化铝,请回答下列问题:

(1)利用上述条件,可制取的气体有(填化学式) ____ __;
(2)若要安全、顺利地制取无水氯化铝,通入A口的气体应是 ______;
(3)用中学化学实验室常用的方法制取通入A口的气体的反应方程式是___ ___
(4)用(3)的方法制得的气体中可能还含有的气体有 ___ ___,通入A口前是否有必要除去,不必除去或必须除去的原因是____ __;
(5)按(3)的方法安装方框图中的装置,所需要的玻璃仪器(同一种仪器,数量在2件或2件以上的要写明件数)有_____ _;
(6)装置图中甲、乙两支干燥管中需要填充碱石灰的是(填甲或乙或甲、乙)______,甲的作用是____ __,乙的作用是___ ___。
查看答案和解析>>
科目:高中化学 来源: 题型:
(16分)无水氯化铝是某些有机化学反应中常用的催化剂,它的熔点190℃但在180℃时已开始升华。它在常温下是一种白色固体,遇水发生剧烈的水解反应,甚至在空气中遇到微量水气也强烈地发烟。用下列装置制取无水氯化铝,回答以下问题:

(1)装置D 中发生的化学反应方程式
(2)仪器X与仪器Y 直接相连的意图是:① 收集产物 ② ,
(3)能否去掉E 装置 ,原因是 ,
(4)实验时应先点燃 处的酒精灯,其作用是
(5)写出铝粉与过量NaOH溶液反应的离子反应方程式
检验上述反应所得含氧酸根的方法(简述实验操作及现象)
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com