
一定温度下,向某容积为VL的密闭容器中充入amol A和bmol B,发生反应:aA(g)+bB(s) cC(g);5min时,测得C为xmol。下列说法中一定正确的是 ( )
cC(g);5min时,测得C为xmol。下列说法中一定正确的是 ( )
A.5 min时,v(C)=x/5Vmol·L-1·s-1
B.缩小容器体积平衡一定发生移动
C.0~5 min 内,v(A):v(C)=a:c
D.0~5min内,用A表示的反应速率为xc/(300aV)mol·L-1·s-1
科目:高中化学 来源:2014年高考化学苏教版总复习 8-2 溶液的酸碱性练习卷(解析版) 题型:填空题
某二元酸(用H2A表示)在水中的电离方程式是:H2A=H++HA-,HA- H++A2-。回答以下问题:
H++A2-。回答以下问题:
(1)NaHA溶液________(填“显酸性”、“显碱性”、“显中性”或“酸碱性无法确定”),原因是______________________。
(2)某温度下,向0.1 mol·L-1的NaHA溶液中滴入0.1 mol·L-1 KOH溶液至中性,此时溶液中以下关系一定正确的是________(填字母)。
A.c(H+)·c(OH-)=1×10-14 mol·L-1
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)=0.05 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-3 化学平衡的移动练习卷(解析版) 题型:选择题
当把晶体N2O4放入恒容的密闭容器中,待全部气化并建立N2O4 2NO2平衡后,保持温度不变,再放入N2O4晶体并全部气化,待反应达到新的平衡,新平衡与旧平衡比较,其值减小的是( )
2NO2平衡后,保持温度不变,再放入N2O4晶体并全部气化,待反应达到新的平衡,新平衡与旧平衡比较,其值减小的是( )
A.c(NO2) B.c(N2O4) C. 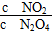 D.
D. 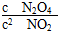
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-2 化学反应的方向和限度练习卷(解析版) 题型:选择题
某温度时,在体积为1 L的密闭容器中,A、B、C三种气体浓度的变化如图Ⅰ所示,若其它条件不变,当温度分别为T1和T2时,B的体积百分含量与时间关系如图Ⅱ所示。则下列结论正确的是( )
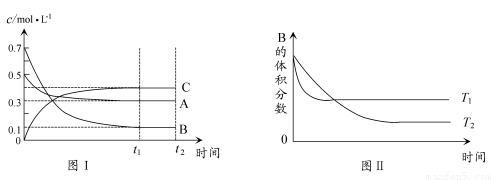
A.该反应的热化学方程式为 :A(g )+3B(g) 2C(g) ΔH>0
2C(g) ΔH>0
B.达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动
C.达到平衡后,若其他条件不变,减小体积,平衡向正反应方向移动
D.若其它条件不变,升高温度,正、逆反应速率均增大,A的转化率增大
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-1 化学反应速率练习卷(解析版) 题型:填空题
甲酸甲酯水解反应方程式为:HCOOCH3(l)+H2O(l) HCOOH(l)+CH3OH(l) ΔH>0,某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:
HCOOH(l)+CH3OH(l) ΔH>0,某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:
组分 | HCOOCH3 | H2O | HCOOH | CH3OH |
物质的量/ mol | 1.00 | 1.99 | 0.01 | 0.52 |
甲酸甲酯转化率在温度T1下随反应时间(t)的变化见下图:
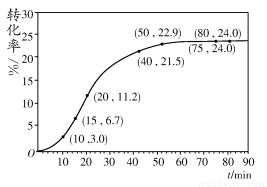
(1)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见下表:
反应时间 范围/min | 0~5 | 10~15 | 20~25 | 30~35 | 40~45 | 50~55 | 75~80 |
平均反应速率 /(10-3 mol·min-1 | 1.9 | 7.4 | 7.8 | 4.4 | 1.6 | 0.8 | 0.0 |
请计算15~20 min范围内甲酸甲酯的减少量为________ mol,甲酸甲酯的平均反应速率为________ mol·min-1(不要求写出计算过程)。
(2)依据以上数据,写出该反应的反应速率在不同阶段的变化规律及其原因:
____________________________________________________________
(3)其他条件不变,仅改变温度为T2(T2大于T1),画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图。

查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-1 化学反应速率练习卷(解析版) 题型:选择题
设C(s)+CO2(g) 2CO(g);ΔH1>0反应速率为v1;设N2(g)+3H2(g)
2CO(g);ΔH1>0反应速率为v1;设N2(g)+3H2(g) 2NH3(g);ΔH2<0反应速率为v2。
2NH3(g);ΔH2<0反应速率为v2。
对于上述反应,当温度降低时,v1和v2的变化情况为( )
A.同时增大 B.同时减小
C.v1增大,v2减小 D.v1减小,v2增大
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 6-3 原电池金属的腐蚀及防护练习卷(解析版) 题型:填空题
如图甲、乙是电化学实验装置。
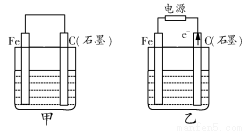
(1)若甲、乙两烧杯中均盛有饱和NaCl溶液。
①甲中石墨棒上的电极反应式为__________________________________;
②乙中总反应的离子方程式为____________________________________;
③将湿润的淀粉-KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。
若反应中Cl2和I2的物质的量之比为5:1,且生成两种酸,该反应的化学方程式为________________________________。
(2)若甲、乙两烧杯中均盛有CuSO4溶液。
①甲中铁棒上的电极反应式为____________________________________;
②如果起始时乙中盛有200 mL pH=5的CuSO4溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入___________(填写物质的化学式)________g。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 6-2 原电池、常见的化学电源练习卷(解析版) 题型:选择题
下图甲和乙是双液原电池装置。由图可判断下列说法错误的是( )

A.甲图电池反应的离子方程式为:Cd(s)+Co2+(aq)=Co(s)+Cd2+(aq)
B.2Ag(s)+Cd2+(aq)=Cd(s)+2Ag+(aq)反应能够发生
C.盐桥的作用是形成闭合回路,并使两边溶液保持电中性
D.乙图当有1 mol电子通过外电路时,正极有108 g Ag析出
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 5-2 元素周期律 元素周期表练习卷(解析版) 题型:选择题
如图为元素F、S、Cl在周期表中的位置,关于F、S、Cl的说法正确的是( )

A.非金属性:F>S>Cl
B.原子半径:Cl>S>F
C.稳定性:HF>HCl>H2S
D.离子半径:Cl->S2->F-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com