
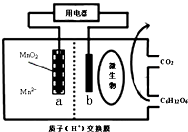
| A. | H+向左移动 | |
| B. | 电子由a极沿导线流向b极 | |
| C. | b极电极反应式为:C6H12O6-24e-+6H2O=6CO2+24H+ | |
| D. | 当电路中转移0.2mole-时,a极质量减少8.7g |
分析 根据图知,通入有机物的一极b为负极,失去时电子发生氧化反应,反应为C6H12O6-24e-+6H2O=6CO2+24H+,a极为正极,得电子发生还原反应,阳离子向正极移动,电子由负极经导线流到正极,根据电极反应计算a极质量的减轻,据此分析解答.
解答 解:根据图知,通入有机物的一极b为负极,失去时电子发生氧化反应,反应为C6H12O6-24e-+6H2O=6CO2+24H+,a极为正极,得电子发生还原反应,阳离子向正极移动,电子由负极经导线流到正极,根据电极反应计算a极质量的减轻,
A.通过以上分析知,b是负极、a是正极,阳离子向正极移动,故A正确;
B.电子由负极经导线流到正极,即为由b移向正极a,故B错误;
C.b为负极,失去时电子发生氧化反应,反应为C6H12O6-24e-+6H2O=6CO2+24H+,故C正确;
D.当电路中转移0.2mole-时,有0.1mol二氧化锰溶解,即a极质量减少8.7,故D正确;
故选B.
点评 本题考查了原电池原理,根据元素化合价变化判断正负极,再结合反应物、生成物及得失电子书写电极反应式,注意书写电极反应式时要结合电解质特点,根据得失电子数目计算减轻的质量,难度不大.


科目:高中化学 来源: 题型:解答题
 )是一种名贵的香料,又是合成VE、VA、紫罗兰酮、胡萝卜素等的中间体.合成芳樟醇的一种方法如下:
)是一种名贵的香料,又是合成VE、VA、紫罗兰酮、胡萝卜素等的中间体.合成芳樟醇的一种方法如下: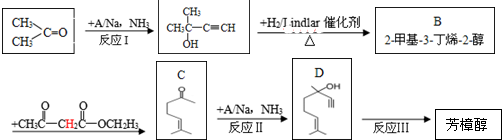
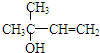 ,C分子中的官能团名称为羰基、碳碳双键,已知反应I和反应Ⅱ的原子利用率100%,则A的结构简式为HC≡CH.
,C分子中的官能团名称为羰基、碳碳双键,已知反应I和反应Ⅱ的原子利用率100%,则A的结构简式为HC≡CH.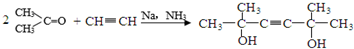 .
. ,写出柠檬醛的另一种同分异构体的结构简式(不改变分子中原子的连接方式)
,写出柠檬醛的另一种同分异构体的结构简式(不改变分子中原子的连接方式)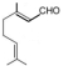 ;芳樟醇在H+作用下也可异构化为香叶醇(
;芳樟醇在H+作用下也可异构化为香叶醇(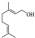 ).下列有关柠檬醛的下列说法正确的是BCD
).下列有关柠檬醛的下列说法正确的是BCD查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol•L-1) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铅蓄电池放电过程中,正极质量增加,负极质量减小 | |
| B. | 反应NH4Cl(s)=NH3(g)+HCl(g)在室温下不能自发进行,则该反应的△H>0 | |
| C. | 一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 | |
| D. | 0.1 mol•L-1 CH3COOH溶液加水稀释后,溶液中c(OH-)、CH3COOH浓度均减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物稳定性:R>Z>W | |
| B. | 原子半径:R<W<Y<Z<X | |
| C. | X分别与W、R形成的化合物的化学键类型不一定相同 | |
| D. | 电解X与R形成化合物的溶液可获得X的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

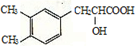 +NaHCO3
+NaHCO3
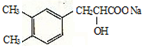 +CO2↑+H2O.
+CO2↑+H2O.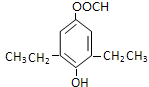 或
或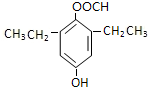 .
.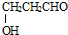 ,请写出以
,请写出以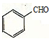 、CH3CH2OH为原料合成
、CH3CH2OH为原料合成 的路线流程图(无机试剂可任选).合成路线流程图如下:
的路线流程图(无机试剂可任选).合成路线流程图如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3BH3中H元素均为+1价 | |
| B. | 合成反应中每生成1 mol NH3BH3会转移2 mol e- | |
| C. | 两个反应中,H2均既是氧化产物,又是还原产物 | |
| D. | 0.1 mol NH3BH3发生上述催化脱氢反应,一定生成6.72 L H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池工作时,有机阳离子通过外电路移向石墨电极 | |
| B. | 若用该电池给钢制品表面电镀Al,则钢制品应该接电池的正极 | |
| C. | 电池充电时,阴极的电极反应式为4Al2Cl7-+3e-=Al+7AlCl4- | |
| D. | 若改用NaOH溶液作电解液,则Al电极的反应式为Al-3e-+3OH-=Al(OH)3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com