
�ٸ���ƿ���ȱ���ʹ��ʯ����
����ȡ����ˮ��װ���¶ȼ�Ҫ������ȵ�ˮ��
�۷�ҺʱҪ����Һ©���Ͽڲ���������ʹ���ϰ��۶�©���ϵ�С��
����Һ©���е���Һʱ��Ҫһֻ�ְ�ס�ڲ�����һֻ����ס�������ֵߵ���
������ƿ�Ŀ̶����Ϸ���ˮ��δ����Ϳ�ʼ������Һ
��ʵ������ȡ����ʱ��Ϊ�˷�ֹ������Ⱦ���������������������������Һ����
A. �٢ڢ� B. �ۢܢ� C. �ڢݢ� D. �ۢݢ�
 ��һ������Ԫͬ�����ؾ�ϵ�д�
��һ������Ԫͬ�����ؾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ������ʡ��һ�����л�ѧ���������棩 ���ͣ�ѡ����
�δ�������ҽѧ���δȵġ�ϴԩ��¼�����С������鶾���ļ��أ��������鶾����ԭ����4Ag+2H2S+O2=2X+2H2O������H2S��
A���Ȳ����������ֲ��ǻ�ԭ�� B����ԭ��
C���������������ǻ�ԭ�� D��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꽭��ʡ�ϲ��е���У�߶�����������ѧ�Ծ��������棩 ���ͣ������
���û�ѧ��Ӧԭ���о����ʵ����ʾ�����Ҫ���塣��ش��������⣺
(1)��CO���Ժϳɼ״�����֪��
CH3OH(g)��3/2O2(g)=CO2(g)��2H2O(l) ��H1kJ��mol��1
CO(g)��1/2O2(g)=CO2(g) ��H2kJ��mol��1
H2(g)��1/2O2(g)=H2O(l) ��H3kJ��mol��1
��CO(g)��2H2(g) CH3OH(g) ��H ��_______kJ��mol��1��
CH3OH(g) ��H ��_______kJ��mol��1��
(2)һ��ѹǿ�£����ݻ�Ϊ2 L���ܱ������г���1mol CO��2 mol H2���ڴ��������·�����Ӧ��CO(g)��2H2(g)  CH3OH(g) ��H ��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
CH3OH(g) ��H ��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
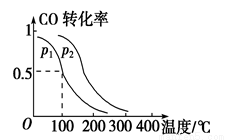
p2 p1 (����ڡ�����С�ڡ����ڡ�)��
(3)��NH4HSO4��Һ�еμ�������Ba(OH)2��Һ�����ӷ���ʽ_______________��
(4)25�棬������ĵ���ƽ�ⳣ�����±���
Ka1 | Ka2 | |
H2SO3 | 1.3��10-2 | 6.3��10-8 |
H2CO3 | 4.2��10-7 | 5.6��10-11 |
��HSO3-�ĵ���ƽ�ⳣ������ʽK=_________��
��0.10 mol��L-1 Na2SO3��Һ������Ũ���ɴ�С��˳��Ϊ_________��
��H2SO3��Һ��NaHCO3��Һ��ϣ���Ҫ��Ӧ�����ӷ���ʽΪ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꽭��ʡ�ϲ��е���У�߶�����������ѧ�Ծ��������棩 ���ͣ�ѡ����
���г����µ�������Һ(���±�)�������й�������ȷ����( )
�� | �� | �� | �� | |
��ˮ | �������� | ���� | ���� | |
pH | 11 | 11 | 3 | 3 |
A���ֱ��ˮϡ��10����������Һ��pHΪ����>��>��>��
B���¶�����10�棬������Һ��pH����
C���ۢ��зֱ�����������Ȼ�茶���۵�pH��С���ܵ�pH����
D�����٢�������Һ�������ϣ�������Һ��c (C1-) >c NH4+)>c (H+)>c (OH- )
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�긣��ʡ�ĵ���У��һ��ѧ��12���¿���ѧ�Ծ��������棩 ���ͣ������
��1����ƽ��
Cu �� HNO3��ϡ�� == Cu��NO3��2 �� NO�� �� H2O
��2�������Ϸ�Ӧ�У���ԭ���� ������ԭ��Ԫ���� ����ԭ������ ��
��3��������2mol��N O���壬�ܹ�ת�Ƶĵ������� mol��
O���壬�ܹ�ת�Ƶĵ������� mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�긣��ʡ�ĵ���У��һ��ѧ��12���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�����ӵ�����ΪNA��������������ȷ���ǣ� ��
A��18gD2O���еĵ�����Ϊ10NA
B��ͬ�¡�ͬѹ�£� ��ͬ����ķ��������������ԭ�������
��ͬ����ķ��������������ԭ�������
C����״���£�11.2L���Ȼ�̼����������ԼΪ0.5NA��
D�������£�46gN2O4��NO2�Ļ�������к��е�ԭ����ԼΪ3NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�긣��ʡ�ĵ���У��һ��ѧ��12���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
ͬ�¡�ͬѹ�£��������O2��O3�������壬�����й�˵���������( )
A������������Ŀ��ͬ B��������ԭ�����ʵ���֮��Ϊ2��3
C������֮��Ϊ2��3 D���ܶ�֮��Ϊ3��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�긣��ʡ�ĵ���У�߶���ѧ��12���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�ѽ�����ѧƽ���ij���淴Ӧ�����ı�����ʹ��ѧƽ��������Ӧ�����ƶ�ʱ�������й�������ȷ��( )
�����������������һ������
��������IJ���һ������
�۷�Ӧ���ת����һ������
�ܷ�Ӧ���Ũ��һ������
������Ӧ����һ�������淴Ӧ����
��ƽ�ⳣ��һ������
A���٢� B���ۢ� C���ڢ� D���ܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017���㽭ʡ������ͳ���Ļ�ѧ�Ծ��������棩 ���ͣ������
�������⡿(10��)̼����͵�Ԫ�ؼ��仯����Ĵ�������Դ���úͻ�����������Ҫ�о����⡣
��1��CO��ת���ɶ����ѣ�ԭ��Ϊ��2CO(g) + 4H2(g) CH3OCH3(g) + H2O(g)����֪һ�������£��÷�Ӧ��CO��ƽ��ת�������¶ȡ�Ͷ�ϱ�[n(H2)/n(CO)]�ı仯������ͼ1
CH3OCH3(g) + H2O(g)����֪һ�������£��÷�Ӧ��CO��ƽ��ת�������¶ȡ�Ͷ�ϱ�[n(H2)/n(CO)]�ı仯������ͼ1
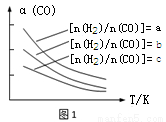
���¶����ߣ���Ӧ��ƽ�ⳣ��K�� �����������С�����䡱����
��2��SO2��ˮ��Һ�����ԣ�ij�¶��£�0.02 mol•L��1������ˮ��Һ��pH����2��������������Ķ��������H2O�ĵ��룬����¶����������һ�����볣��Ka1�� ��
��3����֪�� ��Ӧ1��2SO2(g) + O2(g) ? 2SO3(g) ��H1��
��Ӧ1��2SO2(g) + O2(g) ? 2SO3(g) ��H1��
��Ӧ2��2NO(g) + O2(g) ? 2NO2(g) ��H2��
��Ӧ3��SO2(g) + NO2(g) ? SO3(g) + NO(g) ��H3��
���� H1����H2��0����Ӧ3���� ������ȡ������ȡ�����Ӧ��
H1����H2��0����Ӧ3���� ������ȡ������ȡ�����Ӧ��
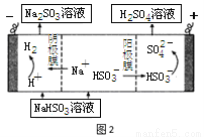
��4����������NaOH��Һ����SO2���壬�Բ���NaHSO3��һ�������Ƶ����ᣬ���ԭ��ʾ��ͼ��ͼ2�����ʱ�����ĵ缫��ӦʽΪ ��
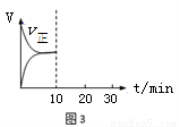
��5���ں����ܱ�������ͨ��SO2��NO2��1mol������Ӧ3��SO2(g) + NO2(g)? SO3(g) + NO(g)������Ӧ�ﵽƽ���ά���¶Ⱥ��ݻ����䣬10minʱ��ͨ���1mol��SO2��NO2�Ļ�����壬20minʱ�ٴ�ƽ�⡣����ƽ��ʱNO2��ת���ʦ�1 ��2�������������������������������ͼ3��������Ӧ����v����10��30min����ʱ��仯������ͼ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com