
 科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列关于该电池叙述错误的是( )
科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列关于该电池叙述错误的是( )| A. | 电池工作时,是将太阳能转化为电能 | |
| B. | 铜电极为正极,电极反应式为:CO2+8e-+8H+=CH4+2H2O | |
| C. | 电池内部H+透过质子交换膜从左向右移动 | |
| D. | 为提高该人工光合系统的工作效率,可向装置中加入少量盐酸 |
分析 该装置中,根据电子流向知,GaN是负极、Cu是正极,负极反应式为:2H2O-4e-=4H++O2↑,正极反应式为:CO2+8e-+8H+=CH4+2H2O,电解质溶液中阳离子向正极移动,据此分析解答.
解答 解:A.根据图示可知,该装置中将太阳能转化为化学能的过程,故A错误;
B.根据电子流向知,Cu是正极,正极上二氧化碳得电子和氢离子反应生成甲烷,电极反应式为:CO2+8e-+8H+=CH4+2H2O,故B正确;
C.放电时,电解质溶液中阳离子向正极移动,所以装置中的H+由左向右移动,故C正确;
D.可向装置中加入少量的酸作电解质,由于盐酸易挥发,生成的甲烷中会混有HCl气体,应加入硫酸,故D错误;
故选AD.
点评 本题考查化学电源新型电池,题目难度中等,明确原电池原理为解答根据,注意正确判断电极反应、电子流向、离子流向,难点是电极反应式的书写.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:选择题
| A. | 二甲苯和四甲苯均有三种 | |
| B. | 乙醇的酯化反应和酯的水解均属于取代反应 | |
| C. | 乙醇、乙酸均可与金属钠反应 | |
| D. | 石油裂解和油脂皂化均是由高分子物质生成小分子物质的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
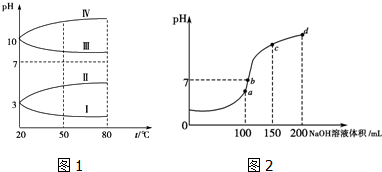
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
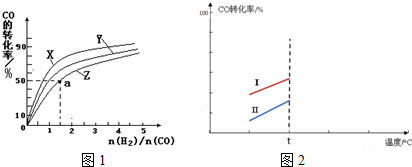
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
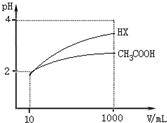 25℃时,三种酸的电离平衡常数如下:
25℃时,三种酸的电离平衡常数如下:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲、乙、丙三种物质之间有如右图所示的转化关系:
甲、乙、丙三种物质之间有如右图所示的转化关系:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com