
| A. | 50mL | B. | 72mL | C. | 78mL | D. | 100mL |
分析 可能发生的反应为:4NO2+O2+2H2O=4HNO3,3NO2+H2O=2HNO3+NO,试管中O2和NO2气体按体积比1:4混合全部溶解,由于将集气瓶从水槽中取出,又见瓶中气体变成红棕色,说明剩余气体为NO,先根据4NO2+O2+2H2O=4HNO3计算剩余二氧化氮体积,然后根据3NO2+H2O=2HNO3+2NO求出过量的NO2,进而计算总的NO2的体积.
解答 解:NO2和O2与水的反应属于循环反应,可简化为:4NO2+O2+2H2O=4HNO3,
由于将集气瓶从水槽中取出,又见瓶中气体变成红棕色,说明剩余气体为NO,
根据3NO2+H2O=2HNO3+NO可知,容器中残留60mL气体,说明剩余的为NO和空气中的氮气,设参加反应的O2气体体积为x,空气中N2和O2按体积比4:1计,剩余氮气为4x,
4NO2+O2+2H2O=4HNO3,3NO2+H2O=2HNO3+NO
4x x (150mL-4x-x-4x) $\frac{1}{3}$(150mL-9x)
$\frac{1}{3}$(150mL-9x)+4x=60mL,解得x=10mL,
则原混合气体中二氧化氮的体积为:4x+(150mL-4x-x-4x)=100mL,
故选D.
点评 本题考查了氮氧化物的性质、混合物有关计算,题目难度中等,合理判断反应后气体组成为解答关键,再结合反应的方程式计算,试题培养了学生的分析及化学计算能力.


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:解答题
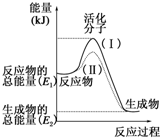 请认真观察如图,然后回答问题.
请认真观察如图,然后回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
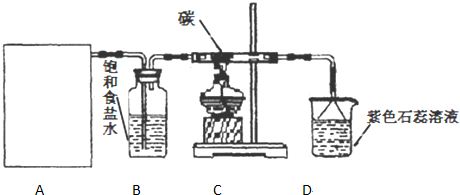
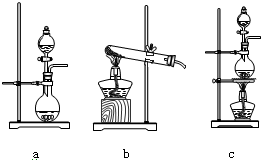
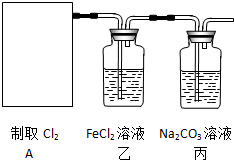
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
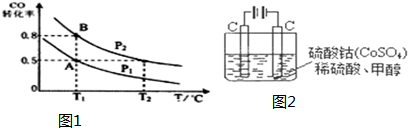
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
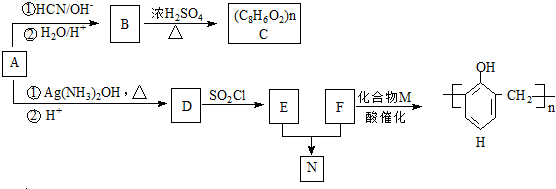
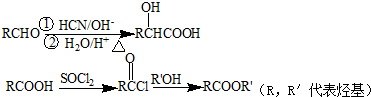 (R,R′代表烃基)
(R,R′代表烃基)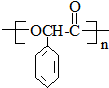 ,M的结构式
,M的结构式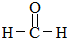 .
. .
.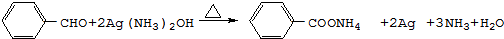 .
.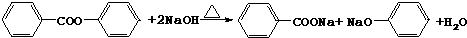 .
.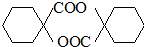 ,其它无机试剂任选.
,其它无机试剂任选.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数为34 | B. | 还原性:H2Se<H2S | ||
| C. | 酸性:H2SeO4<HBrO4 | D. | 稳定性:H2Se>AsH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com